题目内容
在氨的催化氧化中有副反应发生:4NH3+3O2=2N2+6H2O.已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-907kJ/mol,N2(g)+O2(g)=2NO(g)△H2=+180.5kJ/mol.则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的△H为( )
| A、-726.5kJ/mol |
| B、-1087.5kJ/mol |
| C、-1268kJ/mol |
| D、+1994.5kJ/mol |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:根据盖斯定律来解答本题,根据目标反应,将所给的反应做相应的变化从而得出目标反应即可.
解答:
解:已知反应:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-907kJ/mol①
N2(g)+O2(g)=2NO(g)△H2=+180.5kJ/mol②
根据盖斯定律①-2×②可得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=△H1-2×△H2=(-907kJ/mol)-2×(180.5kJ/mol)=-1268KJ/mol
故选C.
N2(g)+O2(g)=2NO(g)△H2=+180.5kJ/mol②
根据盖斯定律①-2×②可得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=△H1-2×△H2=(-907kJ/mol)-2×(180.5kJ/mol)=-1268KJ/mol
故选C.
点评:本题考查了盖斯定律的应用,注意根据目标反应来对所给的反应做相应的调整,较简单.

练习册系列答案
相关题目
已知C4H9-有4种同分异构体,不必写出C4H10O的结构简式,试说明其作为醇的同分异构体的数目( )
| A、2种 | B、4种 | C、3种 | D、5种 |
下列有关化学反应速率的说法不正确的是( )
| A、对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
| B、催化剂能降低化学反应的活化能,加快反应速率,提高生产效率 |
| C、用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 |
| D、化学反应达到最大限度时,正逆反应速率也达到最大且相等 |
将固体NH4I置于密闭容器中,在某温度下,发生下列反应:
NH4I(s)?NH3(g)+HI(g);2HI(g)?H2(g)+I2(g)
当达化学平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则容器中NH3、HI、I2的物质的量之比是( )
NH4I(s)?NH3(g)+HI(g);2HI(g)?H2(g)+I2(g)
当达化学平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则容器中NH3、HI、I2的物质的量之比是( )
| A、8:8:1 |
| B、10:8:1 |
| C、2:2:1 |
| D、3:2:1 |
下列化学用语表示正确的是( )
| A、HClO、KOH的结构式都可用X-Y-Z表示 |
B、O2-、Mg2+的结构中能量最高电子层的轨道表示式都可以用图表示: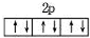 |
C、甲烷、四氯化碳的分子构型相似,均可以表示为: |
| D、分子式中n(C):n(H)=n:(2n+2)的物质不一定是烷烃 |
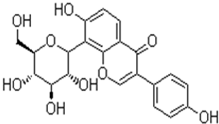 葛根素是由葛根提取制成,主要化学成份为皂苷类化合物葛根黄酮,具有提高免疫,增强心肌收缩力,降低血压,抗血小板聚集等作用.葛根素分子的结构简式如图,下列有关说法正确的是( )
葛根素是由葛根提取制成,主要化学成份为皂苷类化合物葛根黄酮,具有提高免疫,增强心肌收缩力,降低血压,抗血小板聚集等作用.葛根素分子的结构简式如图,下列有关说法正确的是( )| A、该物质一定条件下能发生消去、加成、水解等反应 |
| B、葛根素的分子式为C21H22O9 |
| C、该物质一个分子中含有5个手性碳原子 |
| D、1mol该物质一定条件下最多能消耗H2 8mol,Br2 4mol |
1992年,我国取得的重大科技成果之一是发现了三种元素的新的同位素,其中一种是
Hg,它的质子数与中子数相差( )
208 80 |
| A、80 | B、128 |
| C、208 | D、48 |
 (1)某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图.
(1)某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图.