��Ŀ����
̼������ܱ������м��ȷֽ���������ƺͶ�����̼���ﵽƽ�⣺
CaCO3��s��![]() CaO��s��+CO2��g��
CaO��s��+CO2��g��
��֪298Kʱ���������£�
���� | CaCO3��s�� CaO��s�� CO2��g�� |
| 1206.9 -635.6 -393.5 |
| -1128.8 -604.2 -394.4 |
��298Kʱ�ֽⷴӦ��K![]() �ͷֽ�ѹ����ʯ��Ҥ����ʹCaCO3��s����һ�����ٶȷֽ�,CO2�ķ�ѹӦ������101325 Pa���Լ���ʯ��Ҥ������ά���ڶ��ٶȣ�������˷�Ӧ��
�ͷֽ�ѹ����ʯ��Ҥ����ʹCaCO3��s����һ�����ٶȷֽ�,CO2�ķ�ѹӦ������101325 Pa���Լ���ʯ��Ҥ������ά���ڶ��ٶȣ�������˷�Ӧ�� ![]() ����
����
�� CaCO3��s���ķֽⷴӦ��CaCO3��s�� CaO��s��+CO2��g����Kp=![]() ��
��
����Ӧ��ƽ�ⳣ����ƽ��ʱCO2��g���ķ�ѹ���ѹ��֮�ȡ�
298Kʱ��![]()
![]() +
+![]() -
-![]() =-635.6-393.5+1206.9 =177.8
=-635.6-393.5+1206.9 =177.8 ![]()
![]()
![]()
![]()
![]() = 604.2 -394.4+1128.8 =130.2
= 604.2 -394.4+1128.8 =130.2![]()
![]()
![]()
�ֽ�ѹ = 1.5 ��1023��101325 = 1.52��1018 Pa
��CO2�ķ�ѹӦ������101325Paʱ��ʯ��Ҥ������ά����T K��
![]() ��
��
��![]()
![]() ����
����

T = 1113 K

|
���жԸ���ƽ����ϵ�������У���ȫ��ȷ����һ���� ���ڴ�����Һ�д��ڵĵ���ƽ�⣺CH3COOH �ڳ����£��ڴ�����Һ�м���������CH3COONa���壬��ʹ�����ƽ�������ƶ��� ��ij�¶��£��ݻ�һ�����ܱ������н��п��淴Ӧ��X(g)��Y(g) ���������۵Ŀ��淴Ӧ�У�������������ѹǿ����ʱ����Ӧ�ﵽƽ�⣻ ��һ��Ũ�ȵĴ�������Һ��ʹ��̪��Һ��죬��ԭ������Һ�д�������ƽ�⣺ CH3COO����H2O ����̼��Ƶij����ܽ�ƽ����ϵ�У�����ϡ���ᣬƽ�����ܽ�ķ����ƶ� �����Ȼ����ij����ܽ�ƽ����ϵ�У�����⻯�ع��壬�Ȼ���������ת��Ϊ�⻯������ | |
| [����] | |
A�� |
�٢ڢۢܢ� |
B�� |
�ڢۢܢݢ� |
C�� |
�ڢۢݢޢ� |
D�� |
�٢ڢݢޢ� |
 ��2011?�����һģ����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�����ܵ��������ձ����ӣ�
��2011?�����һģ����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�����ܵ��������ձ����ӣ� HCO3-+OH-
HCO3-+OH-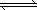 CH3COO����H+����ˮϡ�ͺ���Һ����������Ũ�Ⱦ���С��
CH3COO����H+����ˮϡ�ͺ���Һ����������Ũ�Ⱦ���С��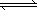 2Z(g)��W(s)����H��0ƽ��������¶ȣ��û�ѧƽ�������ƶ���
2Z(g)��W(s)����H��0ƽ��������¶ȣ��û�ѧƽ�������ƶ���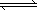 CH3COOH��OH��
CH3COOH��OH�� ���ڴ�����Һ�д��ڵĵ���ƽ�⣺CH3COOH
CH3COO-+H+����ˮϡ�ͺ���Һ����������Ũ�Ⱦ���С��
���ڴ�����Һ�д��ڵĵ���ƽ�⣺CH3COOH
CH3COO-+H+����ˮϡ�ͺ���Һ����������Ũ�Ⱦ���С��
 CH3COO-+H+����ˮϡ�ͺ���Һ����������Ũ�Ⱦ���С��
CH3COO-+H+����ˮϡ�ͺ���Һ����������Ũ�Ⱦ���С��