��Ŀ����
����Ŀ��Na2O2�dz����������ƣ�ij��ѧС���ͬѧ��ͨ������ʵ��ȷ��̿����Na2O2�ķ�Ӧ���
��ʵ�鲽����
��������ͼ��ʾװ������������δ��������װ�����������װ����������

������0.6g̿����3.9gNa2O2���Ȼ�ϣ�װ��Aװ���еķ�Ӧ�������ڿ����Թܿڴ�����һ��ʪ����Ȼ�����ֽ��ʪ���Ȼ�����ֽCO��ڣ������ڼ����Ƿ���CO��������
�����þƾ�������Aװ���еķ�Ӧ����
��ʵ��������
�Թ��з������ҷ�Ӧ���������Ȼ�����ֽδ��ڣ�ʯ��ˮδ�������
�ش�����������
��1����Aװ���з����ڵ���������ѡ��_____________���٢ڢۢܢ���ѡ�������װ�ã�ʹ����װ��ͼ��������

��2��װ��B��������________________��
��3��ͨ��̽�����֣�װ��A��ֻ������Ӧ2Na2O2+C![]() Na2CO3+X����XΪ___________���ѧʽ����
Na2CO3+X����XΪ___________���ѧʽ����
��4��CO�ڳ�ʪ�����пɽ��Ȼ��ٻ�ԭΪ��ɫ��ĩ״������Pd����ͬʱ�����������������ʣ���֪��Ӧ������ת��6.02��1023������ʱ������53g Pd���÷�Ӧ�Ļ�ѧ����ʽΪ________________________��
��5����װ��A����ȫ��Ӧ������������������ˮ�������Һ���ش��������⣺
��������Һ��������___________������ѧʽ����
�����£���ʹ������Һ��100 mLϡ����ǡ����ȫ��Ӧ����ҺpH=7������������ʵ���Ũ��Ϊ___________��
��6��д��Na2O2��һ����Ҫ��;_________________��
���𰸡���1���� ��2����ֹ���� ��3��Na2O
��4��PdCl2+CO+H2O=Pd+CO2+2HC1
��5����NaOH��Na2CO3��1mol/L
��6�����ں����������ΪO2����Դ
��������
�����������1��̼�ۺ������ƶ��ǹ��壬���Ӧѡ��ͼʾװ��
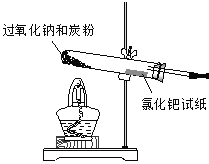
��ѡ������2��CO2���ڳ���ʯ��ˮ���п��ܵ���������װ��B�������Ƿ�ֹ��������3������ԭ���غ��֪��XӦ��������������4��53 g Pd��0.5mol����Ӧ��ת�Ƶ�����1 mol����������������CO2����ʽΪPdCl2 + CO + H2O = Pd + CO2 + 2HCl����5���� ���ò�����̼���ƺ������ƣ���������ˮ�����������������������Һ��������NaOH��Na2CO3���ڹ���������3.9g��78g/mol = 0.05mol��������ԭ���غ��֪���Ȼ�����0.1 mol������Ũ����0.1 mol��0.1 L = 1.0 mol/L����6��2 Na2O2 + 2 CO2 = 2 Na2CO3+O2�������ڿ�ɽ���ӵ���DZˮ������ɴ���ȱ���ij��ϣ������Ǻ�����CO2��ת����O2���Թ�����֮�����������ƾ���ǿ�����ԣ���������Ư��֯����Ʒ����ˡ���ë����

 ��ǰ����ϵ�д�
��ǰ����ϵ�д�




