题目内容
对H3O+的说法正确的是( )
| A、氧原子采取sp2杂化 |
| B、离子是正四面体形 |
| C、离子中存在配位键 |
| D、离子中存在非极性键 |
考点:配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:根据价层电子对互斥理论确定其空间构型,价层电子对数=σ 键个数+
(a-xb);H3O+离子中不存在非极性键,存在的都是H-O极性共价键;
| 1 |
| 2 |
解答:
解:H3O+中,价层电子对数=3+
(6-1-3×1)=4,在H3O+中O原子成3个σ键,其中含有1个配位键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,H3O+空间构型是三角锥形,H3O+离子中不存在非极性键,存在的都是H-O极性共价键,
故选:C.
| 1 |
| 2 |
故选:C.
点评:本题考查了分子空间构型的判断,难度中等,注意理解价层电子对互斥理论与杂化轨道理论.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se)的保健品已经进入市场,已知它与氧元素同主族,与K同周期,关于硒的说法中不正确的是( )
| A、原子序数为34 |
| B、最高价氧化物的水化物的分子式为:H2SeO4 |
| C、Se的非金属性比Br弱 |
| D、气态氢化物的稳定性比硫化氢气体强 |
已知t℃,KW=1×10-12,若在t℃时,某溶液中的c(H+)=1×10-7mol?L-1,则该溶液( )
| A、呈酸性 | B、呈碱性 |
| C、呈中性 | D、不确定 |
在常温下,将pH=11的某碱溶液和pH=3的某酸溶液等体积混合后,下列说法正确的是( )
| A、若所得溶液的PH=5,则可能是强碱与弱酸溶液反应 |
| B、若所得溶液的PH=9,则可能是强碱与弱酸溶液反应 |
| C、若所得溶液呈碱性,则可能是强碱与弱酸溶液反应 |
| D、若所得溶液呈酸性,则可能是强酸与弱碱溶液反应 |
下列反应中,起到氮的固定作用的是( )
| A、NH3经催化氧化生成NO |
| B、N2和O2在一定条件下合成NO |
| C、NO与O2反应生成NO2 |
| D、由NH3制碳酸氢铵 |

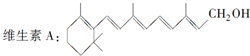 若将有机物分子中碳、氢元素符号省略,而只表示分子中键的连接情况,每个拐点或终点均表示一个碳原子,称为键线式,如丙烷的键线式为.人体对维生素的需要量虽少,但一旦缺乏,人体就不能正常发育,还会引起疾病,下面是维生素A的结构简式:
若将有机物分子中碳、氢元素符号省略,而只表示分子中键的连接情况,每个拐点或终点均表示一个碳原子,称为键线式,如丙烷的键线式为.人体对维生素的需要量虽少,但一旦缺乏,人体就不能正常发育,还会引起疾病,下面是维生素A的结构简式: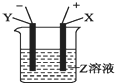 根据如图所示装置回答:
根据如图所示装置回答: