题目内容
【题目】下列表述合理的是
A. 苯与乙炔的实验式均是C2H2
B. 溴乙烷的比例模型是![]()
C. 羟基的电子式:![]()
D. NH3·H2O的电离方程式是NH3·H2O===NH4++OH-
【答案】B
【解析】A.实验式为分子组成的最简比,苯与乙炔的实验式均为CH;B. 比例模型体现的是组成分子的原子间的大小关系;C. 氢原子与氧原子间以共价键结合,电子式为![]() ;D. NH3·H2O为弱电解质,部分电离,电离方程式用“
;D. NH3·H2O为弱电解质,部分电离,电离方程式用“![]() ”。
”。
实验式为分子组成的最简比,即最简式,苯的分子式为C6H6,乙炔的分子式为C2H2,二者的实验式均为CH,A错误;比例模型主要体现的是组成分子的原子间的大小关系,溴乙烷是由乙基和溴原子构成,溴原子半径大于碳原子半径,碳原子半径大于氢原子,图中比例正确,B正确;氢原子与氧原子间以共价键结合,电子式为![]() ,C错误;NH3·H2O为弱碱,部分电离,NH3·H2O
,C错误;NH3·H2O为弱碱,部分电离,NH3·H2O![]() NH4++OH-,D错误;正确选项B。
NH4++OH-,D错误;正确选项B。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
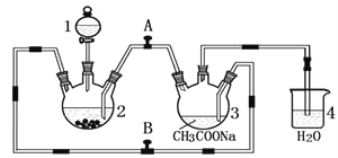
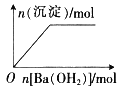
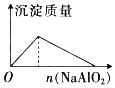
【题目】下列反应中,相关坐标图像错误的是( )
的是
A | B | C | D |
NaHSO4溶液中逐滴加入Ba(OH)2 溶液 | 向盐酸中滴入NaAlO2溶液 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. AB. BC. CD. D