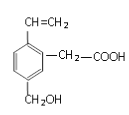
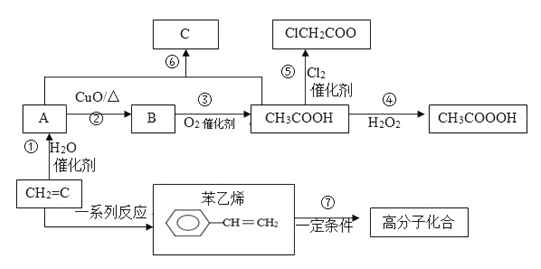
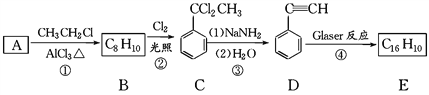
题目内容
【题目】已知反应3Cl2 + 6NaOH=5NaCl + NaClO3 + 3H2O,对该反应的下列说法不正确的( )
A. Cl2既是氧化剂,又是还原剂
B. 反应中转移的电子数为5e-
C. 氧化剂与还原剂的质量比是1∶5
D. 被氧化的氯原子数与被还原的氯原子数之比是1∶5
【答案】C
【解析】A、氯气中氯元素化合价从0价升高到+5价,部分降低到-1价,所以Cl2既是氧化剂,又是还原剂,A正确;B、根据A中分析可知反应中转移的电子数为5e-,B正确;C、根据电子得失守恒可知氧化剂与还原剂的质量比是5∶1,C错误;D、根据电子得失守恒可知被氧化的氯原子数与被还原的氯原子数之比是1∶5,D正确,答案选C。

练习册系列答案
相关题目
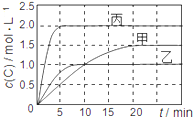
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度 | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是 ( )
A. 由图可知:T1<T2,且该反应为吸热反应
B. T1时该反应的平衡常数K=7.2
C. 前10min甲、乙、丙三个容器中A的平均反应速率:v(A)乙<v(A)甲<v(A)丙
D. 平衡时A的质量m:m乙<m甲<m丙