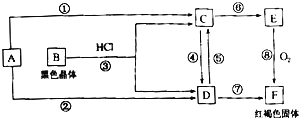
��Ŀ����
����Ŀ����֪����ԭ��HSO3����I�� �� ������IO3����I2 �� �ں�3mol NaHSO3����Һ����μ���KIO3��Һ������KIO3������I2�����ʵ����Ĺ�ϵ������ͼ��ʾ�����в���ȷ���ǣ� �� 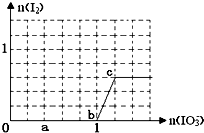
A.0����b��3HSO3��+IO3��=3SO42��+I��+3H+
B.a��ʱ����NaHSO3�����ʵ���Ϊ1.2 mol
C.b��c��I2�Ǽ��ǻ�ԭ����������������
D.����Һ��I��I2�����ʵ���֮��Ϊ5��2ʱ�������KIO3Ϊ1.8mol
���𰸡�D
���������⣺��ԭ��HSO��3��I�� �� ���������Ƿ������·�Ӧ���ӷ���ʽ��IO3��+3HSO3���TI��+3SO42��+3H+ �� ��������KIO3 �� ������IO��3��I2 �� ����IO3�����Խ��H+����I������I2 �� ���ӷ���ʽ��IO3��+6H++5I���T3H2O+3I2 �� A��0��b��û�еⵥ�����ɣ�˵����������Ӻ�������������ӷ���������ԭ��Ӧ���ɵ����ӣ��������ص����ʵ�����1mol�����������Ƶ����ʵ�����3mol�����������������������������ӣ�����ת�Ƶ����غ�֪�����ɵ����ӣ����������ӷ���ʽΪ��3HSO3��+IO3���T3SO42��+I��+3H+ �� ��A��ȷ��
B��a�����ص����ʵ�����0.4mol�����ݵ���غ����������ƵĹ�ϵʽ֪������NaHSO3�����ʵ���= ![]() ��3=1.2mol����B��ȷ��
��3=1.2mol����B��ȷ��
C������ͼ��֪��b��c���ڣ������Ӳ��ֱ��������ɵⵥ�ʣ�������Ӧ�����ӷ���ʽΪIO3��+6H++5I���T3H2O+3I2 �� ����I2��I2�Ǽ��ǻ�ԭ�����������������C��ȷ��
D�����ݷ�Ӧ2IO3��+6HSO3���T2I��+6SO42��+6H+ �� 3mol NaHSO3����Һ����KIO3��Һ�����ʵ���Ϊ1mol�����ɵ����ӵ���Ϊ1mol�������ɵĵⵥ�ʵ����ʵ���Ϊxmol������ݷ�ӦIO3��+6H++5I���T3H2O+3I2 �� ���ĵ�KIO3�����ʵ���Ϊ ![]() xmol�����ĵ����ӵ����ʵ���=
xmol�����ĵ����ӵ����ʵ���= ![]() xmol��ʣ��ĵ����ӵ����ʵ���=��1��
xmol��ʣ��ĵ����ӵ����ʵ���=��1�� ![]() x��mol������Һ��n��I������n��I2��=5��2ʱ������1��
x��mol������Һ��n��I������n��I2��=5��2ʱ������1�� ![]() x����x=5��2��x=0.24mol������ԭ���غ�������ص����ʵ���=1mol+0.24mol��
x����x=5��2��x=0.24mol������ԭ���غ�������ص����ʵ���=1mol+0.24mol�� ![]() =1.08mol����D����
=1.08mol����D����
��ѡD��

 ��У����ϵ�д�
��У����ϵ�д�