题目内容
(Ⅰ)开发新型替代燃料成为各国关注的重要科研项目,中国现已成为世界第三大利用植物秸秆(主要成分纤维素)生产燃料乙醇的国家.已知在25℃条件下,2.3g乙醇完全燃烧生成CO2和液态H2O时放出68.34kJ的热量,写出乙醇燃烧的热化学方程式:
(Ⅱ)乙醇的催化氧化反应在有机合成工业有着广泛的用途.某同学用如图所示的方法进行乙醇的催化氧化实验:向试管中加入3-4mL无水乙醇,浸入50℃左右的热水中,将铜丝烧热,迅速插入乙醇中,反复多次.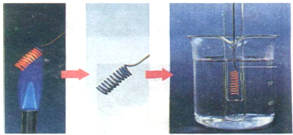
(1)在上述实验过程中,铜丝绕成螺旋状的作用是
(2)铜丝的颜色先后发生的变化是
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ?mol-1
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ?mol-1
.(Ⅱ)乙醇的催化氧化反应在有机合成工业有着广泛的用途.某同学用如图所示的方法进行乙醇的催化氧化实验:向试管中加入3-4mL无水乙醇,浸入50℃左右的热水中,将铜丝烧热,迅速插入乙醇中,反复多次.

(1)在上述实验过程中,铜丝绕成螺旋状的作用是
增大了铜丝的接触面积,加快反应速率
增大了铜丝的接触面积,加快反应速率
.(2)铜丝的颜色先后发生的变化是
铜丝在酒精灯上加热时由红色变为黑色,插入乙醇中时由黑色变为红色
铜丝在酒精灯上加热时由红色变为黑色,插入乙醇中时由黑色变为红色
;请写出相应的两个化学方程式2Cu+O2
2CuO
| ||
2Cu+O2
2CuO
、
| ||
CH3CH2OH+CuO
CH3CHO+Cu+H2O
| △ |
CH3CH2OH+CuO
CH3CHO+Cu+H2O
.| △ |
分析:(Ⅰ)根据书写热化学方程式的方法及题中数据写出乙醇燃烧的热化学方程式;
(Ⅱ)(1)增大了铜丝的接触面积,加快反应速率;
(2)铜在空气中燃烧,由红色变为黑色,插入乙醇中时由黑色变为红色.
(Ⅱ)(1)增大了铜丝的接触面积,加快反应速率;
(2)铜在空气中燃烧,由红色变为黑色,插入乙醇中时由黑色变为红色.
解答:解:(Ⅰ)2.3g乙醇完全燃烧生成CO2和液态H2O时放出68.34kJ的热量,2.3g乙醇的物质的量是0.05mol,1mol乙醇完全燃烧产生的热量是1366.8kJ,乙醇燃烧的热化学方程式是:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ?mol-1,
故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ?mol-1;
(Ⅱ)(1)铜丝绕成螺旋状的作用是:增大了铜丝的接触面积,加快反应速率
故答案为:增大了铜丝的接触面积,加快反应速率;
(2)铜丝的颜色先后发生的变化是:铜丝在酒精灯上加热时由红色变为黑色,插入乙醇中时由黑色变为红色;反应方程式是:2Cu+O2
2CuO CH3CH2OH+CuO
CH3CHO+Cu+H2O;
故答案为:铜丝在酒精灯上加热时由红色变为黑色,插入乙醇中时由黑色变为红色;2Cu+O2
2CuO;CH3CH2OH+CuO
CH3CHO+Cu+H2O.
故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ?mol-1;
(Ⅱ)(1)铜丝绕成螺旋状的作用是:增大了铜丝的接触面积,加快反应速率
故答案为:增大了铜丝的接触面积,加快反应速率;
(2)铜丝的颜色先后发生的变化是:铜丝在酒精灯上加热时由红色变为黑色,插入乙醇中时由黑色变为红色;反应方程式是:2Cu+O2
| ||
| △ |
故答案为:铜丝在酒精灯上加热时由红色变为黑色,插入乙醇中时由黑色变为红色;2Cu+O2
| ||
| △ |
点评:本题考查了乙醇的化学性质,涉及了热化学方程式的书写、化学性质等知识,本题难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目

