题目内容
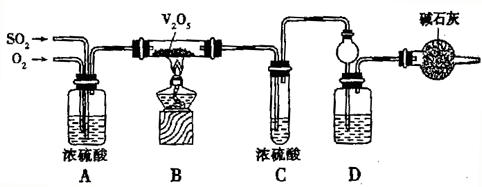
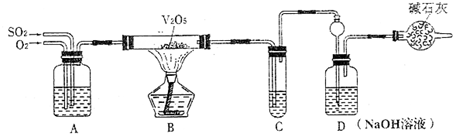
为探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率,甲同学设计了如图装置(图中部分夹持仪器已略去).已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2.
(1)开始进行实验时,首先应进行的操作是 .停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 .
(2)已知0.5mol SO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为 .
(3)实验结束后,若装置D增加的质量为a g,装置E增加的质量为b g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示).
(4)为探究反应后E中的可能生成物,同学们提出了几种假设:
假设1:只有亚硫酸钠;
假设2:只有硫酸钠;
假设3: .
乙同学通过实验证明了假设3成立.请帮助乙同学完成实验操作和现象 .

(1)开始进行实验时,首先应进行的操作是
(2)已知0.5mol SO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
(3)实验结束后,若装置D增加的质量为a g,装置E增加的质量为b g,则此条件下二氧化硫的转化率是
(4)为探究反应后E中的可能生成物,同学们提出了几种假设:
假设1:只有亚硫酸钠;
假设2:只有硫酸钠;
假设3:
乙同学通过实验证明了假设3成立.请帮助乙同学完成实验操作和现象
分析:(1)装置图分析可知制备气体,验证气体性质,开始需要验证装置气密性;为把生成的二氧化硫、三氧化硫全部赶出吸收,停止通入SO2,熄灭酒精灯后,应继续通入空气一会;
(2)依据题干条件计算2mol二氧化硫和氧气反应生成三氧化硫放出热量,结合热化学方程式书写方法写出;
(3)装置D中是利用三氧化硫在冷却条件下冷凝为液体三氧化硫,装置E中是剩余的二氧化硫气体被吸收的质量,结合硫元素守恒计算二氧化硫的转化率;
(4)依据假设1、2可知假设3为硫酸钠和亚硫酸钠都有;依据亚硫酸根离子和硫酸根离子性质设计实验验证.
(2)依据题干条件计算2mol二氧化硫和氧气反应生成三氧化硫放出热量,结合热化学方程式书写方法写出;
(3)装置D中是利用三氧化硫在冷却条件下冷凝为液体三氧化硫,装置E中是剩余的二氧化硫气体被吸收的质量,结合硫元素守恒计算二氧化硫的转化率;
(4)依据假设1、2可知假设3为硫酸钠和亚硫酸钠都有;依据亚硫酸根离子和硫酸根离子性质设计实验验证.
解答:解:(1)装置图分析可知制备气体,验证气体性质,开始需要验证装置气密性;为把生成的二氧化硫、三氧化硫全部赶出吸收,停止通入SO2,熄灭酒精灯后,应继续通入空气一会,
故答案为:检查装置的气密性; 继续通入空气一段时间;
(2)0.5mol SO2被O2氧化成气态SO3,放出49.15kJ热量,则2molSO2被氧气氧化为熟练放热196.6KJ,热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ/mol,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ/mol;
(3)装置D中是利用三氧化硫在冷却条件下冷凝为液体三氧化硫,增重ag为SO3的质量,装置E增重是剩余的二氧化硫气体被吸收的质量,结合硫元素守恒计算二氧化硫的转化率=
×100%=
×100%,
故答案为:
×100%;
(4)依据假设1、2可知假设3为硫酸钠和亚硫酸钠都有;依据亚硫酸根离子和硫酸根离子性质设计实验验证,亚硫酸根离子利用和酸反应生成使品红褪色的二氧化硫气体,硫酸根离子和钡离子反应生成硫酸钡沉淀,设计的实验过程为:取少量E中溶液于试管,先加入过量的稀盐酸,产生的气体使品红溶液褪色(或变浅),证明含有亚硫酸钠;然后加入BaCl2溶液,产生白色沉淀,证明含有硫酸钠,
故答案为:既有亚硫酸钠,也有硫酸钠; 取少量E中溶液于试管,先加入过量的稀盐酸,产生的气体使品红溶液褪色(或变浅),然后加入BaCl2溶液,产生白色沉淀.
故答案为:检查装置的气密性; 继续通入空气一段时间;
(2)0.5mol SO2被O2氧化成气态SO3,放出49.15kJ热量,则2molSO2被氧气氧化为熟练放热196.6KJ,热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ/mol,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ/mol;
(3)装置D中是利用三氧化硫在冷却条件下冷凝为液体三氧化硫,增重ag为SO3的质量,装置E增重是剩余的二氧化硫气体被吸收的质量,结合硫元素守恒计算二氧化硫的转化率=
| ||||
|
| 4a |
| 4a+5b |
故答案为:
| 4a |
| 4a+5b |
(4)依据假设1、2可知假设3为硫酸钠和亚硫酸钠都有;依据亚硫酸根离子和硫酸根离子性质设计实验验证,亚硫酸根离子利用和酸反应生成使品红褪色的二氧化硫气体,硫酸根离子和钡离子反应生成硫酸钡沉淀,设计的实验过程为:取少量E中溶液于试管,先加入过量的稀盐酸,产生的气体使品红溶液褪色(或变浅),证明含有亚硫酸钠;然后加入BaCl2溶液,产生白色沉淀,证明含有硫酸钠,
故答案为:既有亚硫酸钠,也有硫酸钠; 取少量E中溶液于试管,先加入过量的稀盐酸,产生的气体使品红溶液褪色(或变浅),然后加入BaCl2溶液,产生白色沉淀.
点评:本题考查了热化学方程式书写,物质性质的实验探究分析和实验验证方法的设计分析应用,掌握物质性质和实验基本操作是解题关键,题目难度中等.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目