题目内容
【题目】根据所学知识填空:
(1)0.3molNH3中所含质子数与______gH2O分子中所含质子数相等。
(2)标准状况下,2.4g某气体的体枳为672mL,则此气体的相对分子质量为__________。
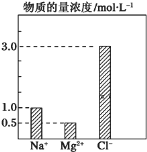
(3)某盐混合溶液中含有离子:Na+、Mg2+、 Cl-、SO42-,测得Na+、Mg2+和C1-的物质的量浓度依次为:0.2mol/L、0.25mol/L、0.4mol/L,测得c(SO42-)=__________。
(4)己知离子反应:RO33-+6I-+6H+=R-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒”等判断:n=___________,R元素在中RO33-的化合价是_____________。
(5)同温同压下,SO2与O2的密度之比为___________,若质量相同,两种气体的体积比为__________。
【答案】
(1)5.4g
(2)80
(3)0.15mol/L
(4)1;+5。
(5)2:1;1:2
【解析】
试题分析:(1)0.3molNH3含有的质子数的物质的量为0.3mol×(7+3)=3mol,而1molH2O含有(2×1+8)mol=10mol质子,则应有0.3molH2O,质量为m(H2O)=0.3mol×18g/mol=5.4g,故答案为:5.4g;
(2)n=0.672L/22.4L/mol=0.03mol,M=m/n=2.4g/0.03mol=80g/mol,则相对分子质量为80,故答案为:80;
(3)根据电荷守恒得c(SO42-)=![]() =
=![]() mol/L=0.15 molL-1,故答案为:0.15 molL-1;
mol/L=0.15 molL-1,故答案为:0.15 molL-1;
(4)由电荷守恒可知反应RO3n-+6I-+6H+═R-+3I2+3H2O中,n=1,则RO3-中R的化合价为+5价,故答案为:1;+5;
(5)同温同压下,气体的密度之比等于相对分子质量之比,SO2与O2的密度之比为64:32=2:1,同温同压下,气体的体积之比等于物质的量之比,质量相同,两种气体的体积比为![]() :
:![]() =1:2,故答案为:2:1;1:2。
=1:2,故答案为:2:1;1:2。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案