题目内容
工业制备纯碱的方法是氨碱法.其主要过程是:
①冷却时将氨气通入食盐水,制得饱和的氨化盐水;②在加压时通入CO2,发生反应:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
然后将滤出的小苏打焙烧制得纯碱:
2NaHCO3 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
母液中的NH4Cl可加入Ca(OH)2回收氨,反应为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,但大量生成的CaCl2用途不大,难以处理.1942年我国化学家侯德榜发明了侯氏制碱法,对氨碱法进行了改进.他将析出NaHCO3后的母液于5~10℃加入食盐粉末,使原来不易结晶的NH4Cl析出晶体,供化肥和其他工业使用.侯氏制碱法成为世界上生产纯碱的重要方法.通过上面资料回答:
(1)氨碱法除回收NH3循环使用外,还有哪些物质可回收使用?
(2)侯氏制碱法除不必生产难以处理的CaCl2外,从原料NaCl的利用上分析,最主要的显著优点为________________________________________.
(3)氨碱法及侯氏制碱法都要用到有关物质的溶解度数据,现列出下表:(单位:g/100g H2O)

a.为什么侯氏制碱法使NH4Cl晶体析出选在5~10℃?
b.氨碱法在②中反应温度在20℃左右,为什么会有NaHCO3晶体析出?
答案:
解析:
解析:
|
(1)焙烧NaHCO3放出的CO2也可回收利用 (2)使NaCl中的Cl-转入NH4Cl中而使NaCl被充分利用 (3)a.此温度下,NH4Cl的溶解度小于NaCl的溶解度; b.在此温度下,四种盐中NaHCO3的溶解度最小,所以Na+与 |

练习册系列答案
相关题目
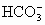 结合成NaHCO3沉淀而析出.
结合成NaHCO3沉淀而析出.