题目内容
(8分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)下列各项能作为判断反应Ⅰ在2 L的密闭容器中达到化学平衡状态的依据的是_______(填序号字母)。
A.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.2v(H2)(正)= v(CO)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)下列各项能作为判断反应Ⅰ在2 L的密闭容器中达到化学平衡状态的依据的是_______(填序号字母)。
A.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.2v(H2)(正)= v(CO)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(1)①Ⅰ ②< ③80% 250 ℃ (2)C
(3)CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442.8 kJ·mol-
(3)CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442.8 kJ·mol-
试题分析:(1) ①工业上一般采用下列两种反应合成甲醇:反应Ⅰ:CO (g)+2H2(g)
 CH3OH(g) 原子的利用率为100%,反应Ⅱ:CO2(g)+3H2(g)
CH3OH(g) 原子的利用率为100%,反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)有副产物水生成,符合“原子经济”原则的是Ⅰ;②分析题给数据知,随着温度的升高,化学平衡常数逐渐减小,平衡逆向移动,升高温度,平衡向吸热反应方向移动,故反应Ⅰ为放热反应,ΔH1<0;③平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率= n(CO)(反应)/ n(CO)(起始)×100%=(2—0.4)mol/2mol×100%=80%;
CH3OH(g)+H2O(g)有副产物水生成,符合“原子经济”原则的是Ⅰ;②分析题给数据知,随着温度的升高,化学平衡常数逐渐减小,平衡逆向移动,升高温度,平衡向吸热反应方向移动,故反应Ⅰ为放热反应,ΔH1<0;③平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率= n(CO)(反应)/ n(CO)(起始)×100%=(2—0.4)mol/2mol×100%=80%;CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)起始浓度(mol/L) 1 3 0
转化浓度(mol/L) 0.8 1.6 0.8
平衡浓度(mol/L) 0.2 1.4 0.8
平衡常数K=2.041,所以是250℃;(2)A、容器内CO、H2、CH3OH的浓度之比为1∶2∶1,不一定为化学平衡状态,错误;B、2v(H2)(正)= v(CO)(逆),速率之比不等于化学计量数之比,错误;C、根据阿伏加德罗定律:同温同体积下,气体的压强之比等于物质的量之比,该反应正反应为气体物质的量减小的反应,压强随反应的进行不断变化,容器内压强保持不变,说明反应已达化学平衡状态,正确;D、根据质量守恒定律知,混合气体的质量反应前后相同,容器的体积恒定,所以密度不随反应的进行而变化,密度保持不变不能作为化学平衡的标志,错误,选C;
(3)已知:①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1,根据盖斯定律:①×1/2—②×1/2+③×2得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442.8 kJ·mol-1。

练习册系列答案
相关题目
 ?pC(g)+2D(g),生成0.5 mol D,又知C的平均反应速率是0.1 mol/(L·s),则下列说法中正确的是
?pC(g)+2D(g),生成0.5 mol D,又知C的平均反应速率是0.1 mol/(L·s),则下列说法中正确的是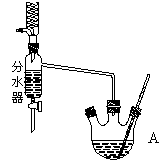
 实验测得不同温度下的平衡数据列于下表:
实验测得不同温度下的平衡数据列于下表:
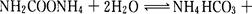
 该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。

 3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率
3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率