题目内容
新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下: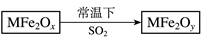
则下列判断正确的是( )
| A.MFe2Ox是氧化剂 | B.SO2是该反应的催化剂 |
| C.x<y | D.MFe2Oy是还原产物 |
C
解析试题分析:此题中反应物已知为MFe2OX和SO2,因为SO2失去氧原子转化为S,化合价降低,做氧化剂,A选项、B选项不正确;MFe2OX反应后生成MFe2Oy,化合价必然升高,MFe2OX做还原剂,MFe2Oy是氧化产物,D选项不正确,再根据氧原子守恒,SO2转化为S,氧原子数减少,MFe2OX转化为MFe2Oy,氧原子数必然增加,故x<y,C选项正确;反应式为:MFe2OX+SO2 MFe2Oy+S。
MFe2Oy+S。
考点:考查氧化还原反应。

已知酸性高锰酸钾溶液可以将FeSO4氧化,化学方程式为2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,
则下列有关说法中不正确的是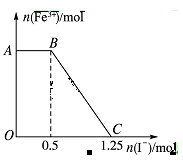
| A.图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol |
| D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
下列化学变化中,必须加入氧化剂才能实现的是
| A.SO2→H2SO3 | B.Cl2→NaClO | C.Fe→FeCl2 | D.HNO3→O2 |
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。则下列说法正确的是
| A.反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D.若反应中转移的电子数目为6.02×1023,生成22.4L NO气体 |
已知X和Y是两种单质,X+Y→X2++Y2-,现有下列叙述正确的是: ①X被氧化,②X是氧化剂,③Y2-是还原产物,④X2+具有氧化性,⑤Y2-具有还原性,⑥Y单质氧化性比X2+氧化性强( )
| A.①②③ | B.①②⑥ | C.①③④⑤⑥ | D.①③④⑤ |
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂,C是还原剂 | B.每生成1molCO需转移2mol电子 |
| C.AlN中氮元素的化合价为+3 | D.AlN的摩尔质量为41 |
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4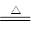 2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法不正确的是( )
| A.CO2是氧化产物 |
| B.H2C2O4在反应中被氧化 |
| C.1mol KClO3参加反应,转移的电子为1mol |
| D.H2C2O4的氧化性强于ClO2的氧化性 |
固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是( )
| A.1molNH5中有5NA个N—H键(NA为阿伏加德罗常数) |
| B.NH5中既有共价键、又有离子键,是离子晶体 |
| C.NH5跟水的反应是氧化还原反应 |
| D.NH5跟水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑ |
在相同条件下的三个反应: 2A- +B2 =2B- +A2; 2C- +A2 =2A- +C2; 2B- +D2 =2D- +B2,下列判断不正确的是( )
| A.氧化性: B2> A2 | B.还原性: C- > D- |
| C.2A- +D2 =2D- + A2反应可以进行 | D.2C- +B2 =2B- + C2反应不能进行 |