题目内容
【题目】向两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列说法正确的是( )
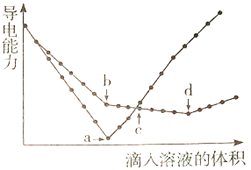
A. a、d两点的溶液中Ba2+均恰好沉淀完全
B. b点的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C. d点溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
D. 溶液中由水电离的c(OH-)大小关系:a=d>c>b滴入溶液的体积
【答案】D
【解析】Ba(OH)2溶液与H2SO4溶液反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,当Ba(OH)2溶液与H2SO4溶液恰好反应时,溶液导电能力最小(图中a点);Ba(OH)2溶液与NaHSO4溶液反应:滴入少量NaHSO4溶液时,发生反应Ba2++OH-+H++SO42-=BaSO4↓+H2O,Ba2+沉淀完全,溶液中OH-有剩余,溶质为NaOH(图中b点);继续滴加NaHSO4溶液时,发生反应OH-+H+=H2O,OH-完全反应完,溶液中离子浓度降到最低,溶液中的溶质为硫酸钠,导电能力最弱(图中d点);根据以上分析可知,a、b两点的溶液中Ba2+均恰好沉淀完全,A错误;b点时,Ba(OH)2溶液与NaHSO4溶液反应,Ba2+沉淀完全,离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,B错误;结合以上分析可知,反应进行到d点时,溶液中的溶质为硫酸钠,根据电荷守恒可知:c(Na+)+c(H+)=2c(SO42-)+c(OH-),C错误;a点为水,d点为硫酸钠溶液,强酸强碱盐,不水解,对水平衡无影响;b点为氢氧化钠溶液,抑制水电离;c点为氢氧化钠和硫酸钠的混合液,抑制水电离,但是比b点抑制程度小一些;因此溶液中由水电离的c(OH-)大小关系:a=d>c>b,D正确;正确选项D。