题目内容
在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定的条件下发生如下反应:
(Ⅰ)
H2(g)+I2(g)![]() 2HI(g)(正反应为放热反应)
2HI(g)(正反应为放热反应)
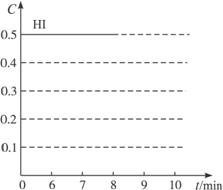
该反应的化学平衡常数表达式为K=![]() ,反应各物质的浓度随时间变化情况如图(Ⅰ):
,反应各物质的浓度随时间变化情况如图(Ⅰ):
(1)根据图(Ⅰ)数据,反应开始至达到平衡时,平均速率v(HI)为_______________。
(2)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K______________。(填增大、减小或不变)
HI浓度的变化正确的是______________。(用图(Ⅱ)中a—c的编号作答)
②若加入I2,H2浓度的变化正确的是_______________。(用图(Ⅱ)中d—f的编号作答)
(3)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图(Ⅲ)中画出8分钟后HI浓度的变化情况。

(Ⅱ)
(Ⅲ)
解析:本题考查可逆反应的相关知识点。(1)根据图Ⅰ,找出3 min达到平衡时,![]()
(2)①升高温度时,由于正反应是放热反应,所以平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以化学平衡常数K减小,HI浓度减小,所以为c。②在体积不变的容器中,若加入I2,平衡将向正反应方向移动,H2的浓度将减小,所以为f。
(3)反应达到平衡后,第8 min时,若反应容器的容积扩大一倍,由于可逆反应前后气体的物质的量不变,所以平衡不动,只是浓度都减半,速率都减半而已。所以在8 min之前,浓度为0.5 mol·L-1,8 min之后,浓度为0.25 mol·L-1,见图。
答案:(1)0.167 mol·L-1·min-1
(2)①减小 c ②f
(3)见下图


练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



 CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)
CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g) + H2(g);1molCO完全反应放热a kJ。反应达到平衡后,测得n(CO2)=
0.8mol下列说法正确的是(
)
CO2(g) + H2(g);1molCO完全反应放热a kJ。反应达到平衡后,测得n(CO2)=
0.8mol下列说法正确的是(
)