题目内容
12.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知: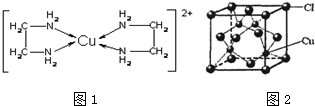
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl2+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):请回答下列问题:
(1)铜原子基态外围电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,H、N、O三种元素的第一电离能由大到小的顺序是O>N>H;
(2)SO42-的空间构型为正四面体型;
(3)乙二胺分子中氮原子轨道的杂化类型为sp3杂化,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.
(4)配离子[Cu(En)2]2+的配位数为4,该微粒含有的微粒间的作用力类型有ABD
A.配位键 B.极性键 C.离子键
D.非极性键 E.氢键 F.金属键
(5)CuCl的晶胞结构如图2所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为4.
分析 (1)根据铜的原子序数为29,结合能量最低原理书写基态原子的电子排布式,根据电负性的变化规律比较电负性大小;
(2)根据价层电子对互斥理论判断离子构型;
(3)根据价层电子对数判断乙二胺分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低不同的原因;
(4)由图1可知配离子[Cu(En)2]2+的配位数为4,离子中存在配位键、C-N键、C-H键、N-H键、C-C键,据此判断离子化学键类型;
(5)由CuCl的晶胞结构图可知,每个Cu+周围有4个Cl-,故每个Cl-周围有4个Cu+.
解答 解:(1)铜的原子序数为29,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,在元素周期表中同一周期从左到右元素的电负性逐渐增强,同一主族从上到下元素的电负性逐渐减弱,可知电负性强弱顺序为O>N>H,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;O>N>H;
(2)SO42-离子中价层电子对数为4+$\frac{1}{2}$=4,孤电子对数为0,所以是正四面体体型,
故答案为:正四面体型;
(3)乙二胺分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,
故答案为:sp3杂化;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)由图1可知配离子[Cu(En)2]2+的配位数为4;
离子中存在配位键、C-N键、C-H键、N-H键、C-C键,其中C-N键、C-H键、N-H键为极性键,C-C键为非极性键,故离子含有配位键、极性键、非极性键,故选ABD.
故答案为:4;ABD;
(5)由CuCl的晶胞结构图可知,每个Cu+周围有4个Cl-,故每个Cl-周围有4个Cu+,故答案为:4.
点评 本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、氢键、化学键类型以及晶体结构分析等知识,题目具有一定难度,本题注意晶胞配位数的判断方法,可根据CuCl的化学式进行比较.

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案 一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意图如图.下面对这种电池的说法不正确的是( )
一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意图如图.下面对这种电池的说法不正确的是( )| A. | 该电池在工作时,溶液中的阳离子向正极移动 | |
| B. | 设每个电子所带电量为q库仑,NA表示阿伏加德罗常数,则46g乙醇被氧化产生12NAq库仑的电量 | |
| C. | 电池工作时电子由a极沿导线经灯泡再到b极 | |
| D. | 电池正极的电极反应式为:O2+4e-+2H2O═4OH- |
| A. | 石灰石高温分解 | B. | 铝与盐酸的反应 | ||
| C. | 二氧化碳与碳反应 | D. | 氢氧化钡晶体与氯化铵反应 |
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=0.8mol•L-1•s-1 | D. | v( D )=1.0mol•L-1•s-1 |