题目内容
2.下列解释事实的方程式不准确的是( )| A. | 铝热法炼铁:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe | |
| B. | 工业上用NH3制备NO:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | |
| C. | 向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32-+2H+═H2O+CO2↑ | |
| D. | 过氧化钠用于呼吸面具中作为氧气的来源:2Na2O2+2CO2═2Na2CO3+O2 |
分析 根据物质的性质,结合化学原理,在生活中进行合理的应用时要正确使用化学用语.书写方程式要符合客观事实,遵循原子守恒,电子守恒,电荷守恒.
A、铝热法是以铝为还原剂的一类反应,条件需“高温”.可冶炼高熔点的铁;
B、工业上利用氨气制硝酸时,首先要将氨气催化氧化成NO.有关方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO;
C、难溶、难电离的物质在离子方程式的书写时,不能拆分;
D、过氧化钠可与H2O和CO2反应产生O2,可用作供氧剂.
解答 解:A、铝热法炼铁是利用铝热反应,用较活泼的金属铝置换出活泼性较弱其他金属,主要冶炼高熔点的金属,如铁、铬、锰、钒等,写方程式注意条件为“高温”.故A正确;
B、工业上利用氨气制硝酸时,首先要将氨气催化氧化成NO,有关反应为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.故B正确;
C、难溶、难电离的物质在离子方程式的书写时,不能拆分,CaCO3难溶于水,不能拆,应写为:CaCO3+2H+═H2O+CO2↑+Ca2+,故C错误;
D、过氧化钠与可与呼吸过程中产生的CO2反应产生O2,方程式为:2Na2O2+2CO2═2Na2CO3+O2,故D正确;
故选C.
点评 本题主要考察方程式的书写,是高考中常考的内容,但是比较简单,需要加强理解记忆.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.石油、煤加工是各种脂肪烃的重要来源,下列判断正确的是( )
| A. | 石油常压蒸馏得到的汽油属于纯净物 | |
| B. | 石油减压蒸馏、煤的液化和气化都是化学变化 | |
| C. | 石油催化裂化的目的是获得更多甲烷 | |
| D. | 石油催化裂化的产物能使溴水和酸性KMnO4溶液褪色 |
8.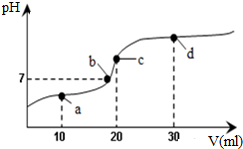 常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )
常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )
 常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )
常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )| A. | a点:c(CH3COO-)>c(Ba2+)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | a至d点过程中:c(Ba2+)一定大于c(OH-) | |
| C. | c点:c(CH3COOH)+c(H+)=c(OH-) | |
| D. | d点:c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+) |
7.下列关于氯水的叙述,正确的是( )
| A. | 氯水中只含Cl2和HClO两种分子 | |
| B. | 新制氯水只能使蓝色石蕊试纸变红 | |
| C. | 光照氯水有气泡逸出,该气体主要是Cl2 | |
| D. | 氯水放置数天后其pH将变小,酸性增强 |
14.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 原子半径:X<W | C. | 热稳定性:H2Y>HZ | D. | 还原性:Y2->Z- |
11.某烷烃分子中含有手性碳原子,该烷烃分子中的碳原子数至少为( )
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
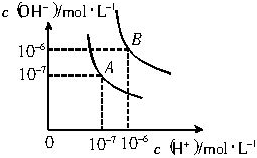 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示. 在一定温度下某密闭容器中,加入1moA、3molB、2molC和2molD,发生反应:m A(g)+n B(g)?x C(g)+y D(s),各物质的物质的量随着时间的变化如图所示,则当下列条件成立时,能说明反应已经达到平衡状态的是( )
在一定温度下某密闭容器中,加入1moA、3molB、2molC和2molD,发生反应:m A(g)+n B(g)?x C(g)+y D(s),各物质的物质的量随着时间的变化如图所示,则当下列条件成立时,能说明反应已经达到平衡状态的是( )