��Ŀ����
����Ŀ����һ���ҹ����ú�ˮ���ξ����ƾõ���ʷ��Ŀǰ���Ӻ�ˮ���Ƶõ��Ȼ��Ƴ�ʳ���⣬������Ҫ�Ĺ�ҵԭ�ϣ��Ӻ�ˮ�������������������¡�
![]()
��ش�
��1�����з�Ӧ�Ļ�ѧ����ʽ��_____________________��
��2����Ϊ�˵õ����Σ���ȥ�����к���������ɳ��Mg2+��Ca2+��SO42-�ȣ����Ʊ����ε���ȷ�IJ���˳����________������ĸ����
a.�������ܽ� b.���� c.���� d.���������̼������Һ e.����������Ȼ�����Һf. �������������������Һ g. �������ᣬ����Һ��pH�Դ���7
��3���ڣ�2����d������Ŀ����______________________��
��4����Ҫ�Ʊ�2.3�ֽ����ƣ���������Ҫ����������Ϊ90%�Ȼ��ƵĴ��ε�������___�֡�
�������ס��ҡ�����λͬѧ�ֱ�����������ʵ��װ�ü���ѧҩƷ�����м�ʯ��Ϊ�����������ƺ���ʯ�ҵĻ�����ȡ�������������̽�������ش��������⣺

��1����λͬѧ��ȡ�����Ļ�ѧ����ʽ��:_________________��
��2����λͬѧ������װ����ȡ����ʱ��������һλͬѧû���ռ���������ʵ���������ȷ��������Ϊû���ռ���������ͬѧ��______������������������������������
��3��Ϊȷ���Թ����Ƿ����ռ���������Ӧ��ʪ��ĺ�ɫʯ����ֽ�����ռ�������Թܿڴ������۲쵽____________________����˵���������ռ�����
��4����λͬѧ����Ϊ���ǵ�ʵ��װ�û������ڼ���̼����粒�������ȡ�����İ��������ж��ܹ��ﵽʵ��Ŀ�ĵ�ͬѧ��______������������������������������
���𰸡� 2NaCl��������![]() 2Na+Cl2�� aefdbgc����afedbgc��aedfbgc�� ��ȥ��Һ��Ba2+��Ca2+ 6.5 2NH4Cl+Ca(OH)2
2Na+Cl2�� aefdbgc����afedbgc��aedfbgc�� ��ȥ��Һ��Ba2+��Ca2+ 6.5 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O �� ��ֽ���� ��
CaCl2+2NH3��+2H2O �� ��ֽ���� ��
����������һ����1��������ڵ��Ȼ��ƿ��Եõ������ƣ�����з�Ӧ�Ļ�ѧ����ʽ��2NaCl�����ڣ�![]() 2Na+Cl2������2�������ᴿ�IJ������ܽ⡢���ӡ����ˡ��������ڳ���ʱ�������̼����Ҫ���ڼ����Ȼ���֮���Ա㽫��Ӧʣ����Ȼ�����ȥ����������������Һ��pHֵ��������ȷ�IJ���˳����aefdbgc����afedbgc��aedfbgc������3���������Ϸ�����֪�ڣ�2����d������Ŀ���dz�ȥ��Һ��Ba2+��Ca2+����4��������ԭ���غ��֪��������Ҫ����������Ϊ90%�Ȼ��ƵĴ��ε�������
2Na+Cl2������2�������ᴿ�IJ������ܽ⡢���ӡ����ˡ��������ڳ���ʱ�������̼����Ҫ���ڼ����Ȼ���֮���Ա㽫��Ӧʣ����Ȼ�����ȥ����������������Һ��pHֵ��������ȷ�IJ���˳����aefdbgc����afedbgc��aedfbgc������3���������Ϸ�����֪�ڣ�2����d������Ŀ���dz�ȥ��Һ��Ba2+��Ca2+����4��������ԭ���غ��֪��������Ҫ����������Ϊ90%�Ȼ��ƵĴ��ε������� ��
��
��������1������װ��ͼ��֪��λͬѧ��ȡ�����Ļ�ѧ����ʽΪ2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O����2�������Ǽ������壬�������ᷴӦ������û���ռ���������ͬѧ���ҡ���3�������Ǽ������壬���Ϊȷ���Թ����Ƿ����ռ���������Ӧ��ʪ��ĺ�ɫʯ����ֽ�����ռ�������Թܿڴ������۲쵽��ֽ��������˵���������ռ�������4��̼����立ֽ����ɰ�����ˮ��CO2������Ҫ�Ʊ�������Ҫ��ȥCO2��H2O����Ҫ���ü�ʯ��������ܹ��ﵽʵ��Ŀ�ĵ�ͬѧ�DZ���
CaCl2+2NH3��+2H2O����2�������Ǽ������壬�������ᷴӦ������û���ռ���������ͬѧ���ҡ���3�������Ǽ������壬���Ϊȷ���Թ����Ƿ����ռ���������Ӧ��ʪ��ĺ�ɫʯ����ֽ�����ռ�������Թܿڴ������۲쵽��ֽ��������˵���������ռ�������4��̼����立ֽ����ɰ�����ˮ��CO2������Ҫ�Ʊ�������Ҫ��ȥCO2��H2O����Ҫ���ü�ʯ��������ܹ��ﵽʵ��Ŀ�ĵ�ͬѧ�DZ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����Ĺ̶��Ǽ���������ѧ��һֱ�о��Ŀ��⣮
��1���±��о��˲�ͬ�¶��´����̵���ҵ�̵��IJ���Kֵ��
��Ӧ | �����̵� | ��ҵ�̵� | |||
�¶�/�� | 27 | 2000 | 25 | 400 | 450 |
K | 3.84��10��31 | 0.1 | 5��108 | 0.507 | 0.152 |
�ٷ������ݿ�֪�������̵���Ӧ����������ȡ����ȡ�����Ӧ
�ڷ������ݿ�֪������ʺϴ��ģģ������̵�ԭ��
�۴�ƽ��Ƕȿ��ǣ���ҵ�̵�Ӧ��ѡ������������ʵ�ʹ�ҵ����ȴѡ��500�����ҵĸ��£�������ԭ��
��2����ҵ�̵���Ӧ�У�������������ͬʱ���ֱ�ⶨN2��ƽ��ת�����ڲ�ͬѹǿ����1����2�������¶ȱ仯�����ߣ���ͼ��ʾ��ͼʾ�У���ȷ�������A����B�������Ƚϧ�1����2�Ĵ�С��ϵ �� 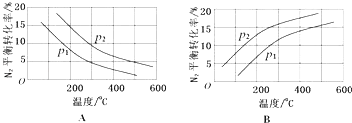
��3�����꣬���п�ѧ������ڳ��¡���ѹ�������������ºϳɰ�������˼·����Ӧԭ��Ϊ��2N2��g��+6H2O��1��4NH3��g��+3O2��g�������䷴Ӧ�ȡ�H= �� ��֪��N2��g��+3H2��g��2NH3��g����H=��92.4kJmol��1
2H2��g��+O2��g��2H2O��l����H=��571.6kJmol��1 ��


