题目内容
VL含有(NH4)2SO4、NH4NO3的混合溶液,加入a mol NaOH后,加热,恰好使NH3全部逸出;又加入b mol BaCl2则刚好使SO42-完全沉淀,则原混合溶液中NH4NO3的物质的量浓度为( )
A.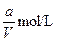 | B.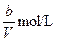 | C. | D. |
C
试题分析:根据混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,则
SO42-+Ba2+=BaSO4↓
bmol bmol
根据加入a mol NaOH后,加热,恰好使NH3全部逸出,则
NH4+ + OH-
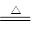 NH3↑+H2O
NH3↑+H2Oamol amol
又因为溶液不显电性,所以由电荷守恒可知,原混合溶液中NH4NO3的物质的量为(a-2b)mol
所以硝酸铵的浓度是
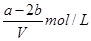 ,所以答案选C。
,所以答案选C。点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生能力的培养和解题方法的指导与训练。明确发生的离子反应及溶液不显电性是解答本题的关键,并熟悉浓度的计算公式来解答即可。

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
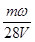 mol·L-1
mol·L-1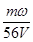 mol·L-1
mol·L-1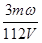 mol·L-1
mol·L-1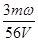 mol·L-1
mol·L-1