题目内容
某同学欲用98%的浓H2SO4(ρ=1.84g/cm3)配制成480mL 0.2mol/L的稀H2SO4溶液(1)浓硫酸的物质的量浓度为______;量筒取用浓H2SO4的体积为______.
(2)填写下列操作步骤:
①将量取的浓H2SO4沿内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌,目的是______.
②立即将上述溶液沿玻璃棒注入______中,并用50mL蒸馏水洗涤烧杯2~3次,并将洗涤液注入其中,并不时轻轻振荡.
③加水至距刻度______处,改用______加水,使溶液的凹液面正好跟刻度相平.盖上瓶塞,上下颠倒数次,摇匀.
请指出上述操作中一处明显错误:______.
(3)误差分析:(填偏高、偏低、无影响)
操作①中用量筒量取浓硫酸时,仰视刻度线取浓硫酸,所配溶液浓度将______;若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将______;操作③中,若定容时,眼睛俯视,则所配制的溶液浓度将______.
【答案】分析:(1)根据c= 计算浓硫酸的物质的量浓度;
计算浓硫酸的物质的量浓度;
根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算所需浓硫酸的体积,注意没有480mL规格的容量瓶,故选择500mL容量瓶;
(2)①当水滴入浓硫酸时,会产生大量的热,造成液滴飞溅,可能伤人;浓硫酸注入水中,放出大量热,用玻璃棒搅拌混合均匀搅拌,使热量迅速分散,防止液体飞溅;
②没有480mL规格的容量瓶,故选择500mL容量瓶,冷却后沿玻璃棒注入500mL容量瓶中;
③加水至距刻度 1~2cm处,改用胶头滴管加水,至溶液凹液面与刻度线水平相切;
稀释后的硫酸应冷却到室温,再沿玻璃棒注入500mL容量瓶中;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=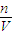 判断对所配溶液浓度影响.
判断对所配溶液浓度影响.
解答:解:(1)98%的浓H2SO4的物质的量浓度为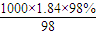 mol/L=18.4mol/L;
mol/L=18.4mol/L;
没有480mL规格的容量瓶,故选择500mL容量瓶,即应配制500mL溶液,根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算所需浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.2mol/L,解得:x≈5.4,所以应量取的浓硫酸体积是5.4mL;
故答案为:18.4mol/L,5.4mL;
(2)①当水滴入浓硫酸时,会产生大量的热,造成液滴飞溅,可能伤人;浓硫酸注入水中,放出大量热,用玻璃棒搅拌混合均匀搅拌,使热量迅速分散,防止液体飞溅;
故答案为:防止液体飞溅;
②没有480mL规格的容量瓶,故选择500mL容量瓶,冷却后沿玻璃棒注入500mL容量瓶中;
故答案为:500mL容量瓶;
③加水至距刻度 1~2cm处,改用胶头滴管加水,至溶液凹液面与刻度线水平相切;
稀释后的硫酸应冷却到室温,再沿玻璃棒注入500mL容量瓶中,故操作②错误;
故答案为:1~2cm,胶头滴管,②;
(3)操作①中用量筒量取浓硫酸时,仰视刻度线取浓硫酸,量取浓硫酸的体积偏大,所配溶液浓度偏高;
溶液配制需加水定容,容量瓶中洗净后未干燥,残留少量水,对所配溶液浓度无影响;
操作③中,若定容时,眼睛俯视,导致所配溶液体积偏小,所配制的溶液浓度偏高;
故答案为:偏高,无影响,偏高.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,注意根据c=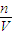 理解溶液配制与误差分析.
理解溶液配制与误差分析.
 计算浓硫酸的物质的量浓度;
计算浓硫酸的物质的量浓度;根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算所需浓硫酸的体积,注意没有480mL规格的容量瓶,故选择500mL容量瓶;
(2)①当水滴入浓硫酸时,会产生大量的热,造成液滴飞溅,可能伤人;浓硫酸注入水中,放出大量热,用玻璃棒搅拌混合均匀搅拌,使热量迅速分散,防止液体飞溅;
②没有480mL规格的容量瓶,故选择500mL容量瓶,冷却后沿玻璃棒注入500mL容量瓶中;
③加水至距刻度 1~2cm处,改用胶头滴管加水,至溶液凹液面与刻度线水平相切;
稀释后的硫酸应冷却到室温,再沿玻璃棒注入500mL容量瓶中;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
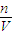 判断对所配溶液浓度影响.
判断对所配溶液浓度影响.解答:解:(1)98%的浓H2SO4的物质的量浓度为
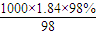 mol/L=18.4mol/L;
mol/L=18.4mol/L;没有480mL规格的容量瓶,故选择500mL容量瓶,即应配制500mL溶液,根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算所需浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.2mol/L,解得:x≈5.4,所以应量取的浓硫酸体积是5.4mL;
故答案为:18.4mol/L,5.4mL;
(2)①当水滴入浓硫酸时,会产生大量的热,造成液滴飞溅,可能伤人;浓硫酸注入水中,放出大量热,用玻璃棒搅拌混合均匀搅拌,使热量迅速分散,防止液体飞溅;
故答案为:防止液体飞溅;
②没有480mL规格的容量瓶,故选择500mL容量瓶,冷却后沿玻璃棒注入500mL容量瓶中;
故答案为:500mL容量瓶;
③加水至距刻度 1~2cm处,改用胶头滴管加水,至溶液凹液面与刻度线水平相切;
稀释后的硫酸应冷却到室温,再沿玻璃棒注入500mL容量瓶中,故操作②错误;
故答案为:1~2cm,胶头滴管,②;
(3)操作①中用量筒量取浓硫酸时,仰视刻度线取浓硫酸,量取浓硫酸的体积偏大,所配溶液浓度偏高;
溶液配制需加水定容,容量瓶中洗净后未干燥,残留少量水,对所配溶液浓度无影响;
操作③中,若定容时,眼睛俯视,导致所配溶液体积偏小,所配制的溶液浓度偏高;
故答案为:偏高,无影响,偏高.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,注意根据c=
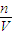 理解溶液配制与误差分析.
理解溶液配制与误差分析. 
练习册系列答案
相关题目