题目内容
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下

甲:①准确配制0.1 mol·L-1的HA、HCl溶液各100mL;
②取纯度相同,质量、大小相等的锌粒放入两只试管中,同时加入0.1 mol·L-1的 HA 、HCl溶液各
10mL,按上图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1 mol·L-1HA和HCl溶液的pH;
②再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/20mL)分别稀释至100mL,再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是测得0.1 mol·L-1的HA溶液的pH______1 (填“>”、“<”或“=”) ;甲方案中,说明HA是弱电解质的实验现象是:___________
A.装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件弱电解质平衡发生移动。加水稀释,弱酸HA的电离程度
___________ (填“增大、减小、不变”)。
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol/L-1的HA溶液中,选择加入_________试剂;
A.NaA固体(可完全溶于水)
B.1 mol/L-1 NaOH溶液
C.1 mol/L-1 H2SO4
D.2 mol/L-1 HA
(4)pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有___________
②取纯度相同,质量、大小相等的锌粒放入两只试管中,同时加入0.1 mol·L-1的 HA 、HCl溶液各
10mL,按上图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1 mol·L-1HA和HCl溶液的pH;
②再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/20mL)分别稀释至100mL,再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是测得0.1 mol·L-1的HA溶液的pH______1 (填“>”、“<”或“=”) ;甲方案中,说明HA是弱电解质的实验现象是:___________
A.装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件弱电解质平衡发生移动。加水稀释,弱酸HA的电离程度
___________ (填“增大、减小、不变”)。
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol/L-1的HA溶液中,选择加入_________试剂;
A.NaA固体(可完全溶于水)
B.1 mol/L-1 NaOH溶液
C.1 mol/L-1 H2SO4
D.2 mol/L-1 HA
(4)pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有___________

A.若a=4,则A是强酸,B是弱酸
B.若1<a<4,则A、B都是弱酸
C.两种酸溶液的物质的量浓度一定相等
D.稀释后,A酸溶液的酸性比B酸溶液弱
B.若1<a<4,则A、B都是弱酸
C.两种酸溶液的物质的量浓度一定相等
D.稀释后,A酸溶液的酸性比B酸溶液弱
(1)>;A
(2)增大
(3)A
(4)C
(2)增大
(3)A
(4)C

练习册系列答案
相关题目
 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下:
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动.实验方案如下: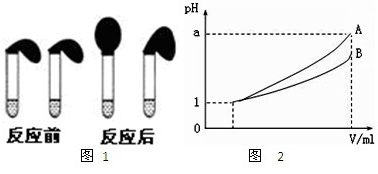

 l溶液各100mL;
l溶液各100mL; )分别稀释至100mL,
)分别稀释至100mL, ·L-1H2SO4 D.2mol·L-1HA
·L-1H2SO4 D.2mol·L-1HA
 ,则A、B都是弱酸
,则A、B都是弱酸
