题目内容
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
[探究一]
实验方案:铝镁合金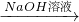 测定剩余固体质量
测定剩余固体质量
实验中发生反应的化学方程式是______
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol?L-1NaOH溶液中,充分反应.NaOH溶液的体积V≥______
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
______(填“偏高”或“偏低”).
[探究二]
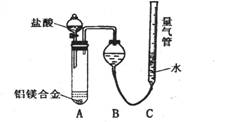
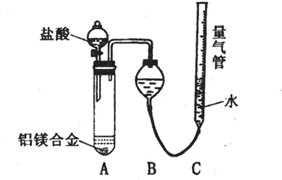
实验方案:铝镁合金 测定生成气体的体积实验装置:
测定生成气体的体积实验装置:
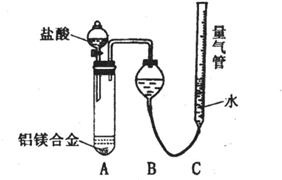
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置.你的意见是:______(填“需要”或“不需要”).
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):①______②______
[探究三]
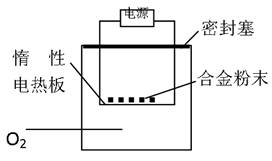
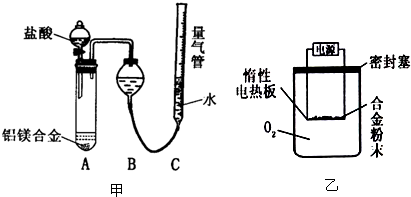
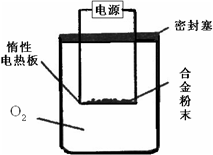
实验方案:称量x g铝镁合金粉末.放在如右图所示装置的惰性电热板上,通电使其充分灼烧.
 问题讨论:
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是______
(2)若用空气代替O2进行实验,对测定结果何影响?______(填“偏高”或“偏低”或“无影响”).
解:探究一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)含镁为零时,金属铝的含量最高,5.4g合金中铝的质量为,5.4g×(1-3%)=5.4×97%g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
5.4g V×10-3L×2.0mol/L
所以54g:5.4g=2mol:(V×10-3L×2.0mol/L),
解得:V=100mL,故V(NaOH溶液)≥100mL;
故答案为:100mL;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,故答案为:偏高;
探究二:(1)由于氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置,故答案为:不需要;
(2)反应中装置的气密性、合金是否完全溶解都会影响测定结果,
故答案为:检查装置的气密性;合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等合理答案);
【探究三】
(1)Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量,故答案为:灼烧后固体的质量;
若用空气代替O2进行实验,发生反应:3Mg+N2 Mg3N2,2Mg+CO
Mg3N2,2Mg+CO 2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高,故答案为:偏高.
2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高,故答案为:偏高.
分析:探究一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
探究二:(1)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置;
(2)装置的气密性、合金是否完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积)等会影响测定结果;
探究三:(1)Mg、Al都能够与氧气化学反应生成氧化物;
(2)用空气代替O2进行实验,发生反应:3Mg+N2 Mg3N2,2Mg+CO
Mg3N2,2Mg+CO 2MgO+C,测定生成固体的质量变大.
2MgO+C,测定生成固体的质量变大.
点评:本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.
(1)含镁为零时,金属铝的含量最高,5.4g合金中铝的质量为,5.4g×(1-3%)=5.4×97%g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
5.4g V×10-3L×2.0mol/L
所以54g:5.4g=2mol:(V×10-3L×2.0mol/L),
解得:V=100mL,故V(NaOH溶液)≥100mL;
故答案为:100mL;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,故答案为:偏高;
探究二:(1)由于氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置,故答案为:不需要;
(2)反应中装置的气密性、合金是否完全溶解都会影响测定结果,
故答案为:检查装置的气密性;合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等合理答案);
【探究三】
(1)Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量,故答案为:灼烧后固体的质量;
若用空气代替O2进行实验,发生反应:3Mg+N2
 Mg3N2,2Mg+CO
Mg3N2,2Mg+CO 2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高,故答案为:偏高.
2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高,故答案为:偏高.分析:探究一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
探究二:(1)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置;
(2)装置的气密性、合金是否完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积)等会影响测定结果;
探究三:(1)Mg、Al都能够与氧气化学反应生成氧化物;
(2)用空气代替O2进行实验,发生反应:3Mg+N2
 Mg3N2,2Mg+CO
Mg3N2,2Mg+CO 2MgO+C,测定生成固体的质量变大.
2MgO+C,测定生成固体的质量变大.点评:本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 问题讨论:
问题讨论:
 测定生成气体的体积
测定生成气体的体积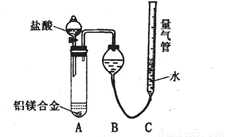

 测定剩余固体质量。
测定剩余固体质量。 测定生成气体的体积(实验装置如下图)
测定生成气体的体积(实验装置如下图)