题目内容
Ⅰ、氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物。
(1)NF3,NBr3、NCl3这三种分子的空间构型是 。
(2)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-。请写出两种与N3-电子数相等的分子 。
(3)NaN3与KN3离子键强弱相比,NaN3 KN3(填“>”、“=”或“<” )。
(4)氮化碳结构如下图, 其硬度超过金刚石晶体,成为首屈一指的超硬新材料。

①写出氮化碳的化学式____ _ _____;
②指出氮化碳的晶体类型______ _____。
Ⅱ、分析表中四种物质的相关数据,请回答:
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
|
沸点/K |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度/K |
873 |
773 |
1073 |
713.2 |
(1)CH4和SiH4比较,沸点高低的原因是____ _______;
(2)NH3和PH3比较,分解温度高低的原因是_____ ______ ;
(3)结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时___________先液化。
【答案】
I (1)三角锥型
(2) 或
或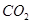
(3)>
(4) ① ②原子晶体
②原子晶体
II (1)结构相似时,相对分子质量越大,分子间作用力越大,因此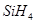 沸点高于
沸点高于
(2)氮的废金属性比磷强,所以氮比磷比氢稳定。(3)HF
【解析】略

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目


 X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z元素是形成化合物种类最多的元素.回答下列问题:
X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z元素是形成化合物种类最多的元素.回答下列问题: