题目内容
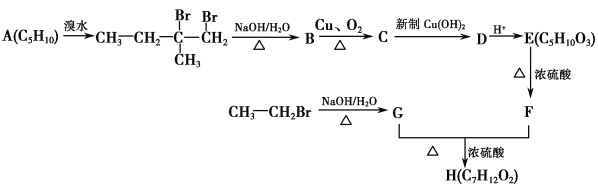
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制备三氯化铬的流程如下图所示:
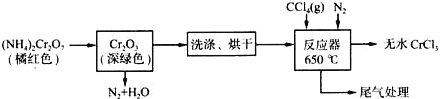
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净?______________________________________________。
(2)用下图装置制备CrCl3时,反应管中发生的主要反应为: Cr2O3+3CCl4==2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为:
①_____________________________________;②_____________________________________。

(3)样品中三氯化铬质量分数的测定:称取样品0.3000g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1g(足量)Na2O2,充分加热煮沸,适当稀释,然后加入过量2mol·L-1H2SO4至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5min后,加入1mL指示剂,用0.0250mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL。(已知:2Na2S2O3+I2== Na2S4O6+2NaI)
①判定终点的现象是_____________;若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果_________(填“偏高”“偏低”或“无影响”)。
②加入Na2O2后要加热煮沸,其主要原因是_______________________________。
③样品中无水三氯化铬的质量分数为_________________。(保留三位有效数字)
【答案】 最后一次的洗涤液呈无色 赶尽反应装置中的氧气 鼓气使反应物进入管式炉中进行反应 最后一滴滴入时,蓝色恰好完全褪去,且半分钟内不恢复原色 偏低 除去其中溶解的氧气,防止氧气将I-氧化,产生误差 92.5%
【解析】(1)因为(NH4)2Cr2O7显桔红色,最后一次洗涤的流出液呈无色,说明洗涤干净;
(2)氮气不能氧化三氯化铬且充入氮气能使反应物进入管式炉中进行反应,为防止三氯化铬被氧化且使反应物进入管式炉中进行反应,充入氮气;
(3)①滴入最后一滴时,如果溶液颜色在半分钟内不变色,则达到滴定终点;若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬反应不完全,所以导致它的质量分数的测量结果偏低;
②溶液中有溶解的氧气,氧气可以氧化I-氧化,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差,故加热煮沸,其主要原因是:除去其中溶解的氧气,防止氧气将I-氧化,产生偏高的误差;
③令25.00mL溶液中n(Cr3+),由Cr元素守恒及方程式可得关系式2Cr3++~Cr2O72-~3I2~6Na2S2O3,根据关系式计算.
2Cr3++~Cr2O72-~3I2~6Na2S2O3,
2 6
n(Cr3+)0.0250mol/L×0.021L
故n(Cr3+)=0.0250mol/L×0.021L×![]() ,所以250mL溶液中n′(Cr3+)=0.0250mol/L×0.021L×
,所以250mL溶液中n′(Cr3+)=0.0250mol/L×0.021L×![]() ×
×![]() =0.00175mol,根据Cr元素守恒可知n(CrCl3)=n′(Cr3+)=0.00175mol,所以样品中m(CrCl3)=0.00175mol×158.5g/mol=0.2774g,故样品中无水三氯化铬的质量分数为
=0.00175mol,根据Cr元素守恒可知n(CrCl3)=n′(Cr3+)=0.00175mol,所以样品中m(CrCl3)=0.00175mol×158.5g/mol=0.2774g,故样品中无水三氯化铬的质量分数为![]() ×100%=92.5%。
×100%=92.5%。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案