题目内容
【题目】下列说法不正确的是________(填序号)。
①铝和盐酸、NaOH溶液的反应中,铝作还原剂
②等质量的铝与足量的盐酸、NaOH溶液反应放出的H2物质的量相等
③等体积等物质的量浓度的盐酸、NaOH溶液与过量的Al反应,产生H2的物质的量相等
④铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2
⑤化学方程式中各物质的化学计量数之比等于各物质的质量之比
⑥根据方程式2Na+2H2O===2NaOH+H2↑,可知2 mol Na与足量水反应放出22.4 L氢气
⑦根据离子方程式Mg+2H+===Mg2++H2↑,可知1 g Mg与足量H+反应生成1 mol氢气
【答案】③⑤⑥⑦
【解析】根据Al与酸、碱反应的数量关系 2Al+6H+===2Al3++3H2↑2Al+2OH-+2H2O===2AlO![]() +3H2↑进行判断。①铝和盐酸、NaOH溶液的反应中,铝作还原剂, ①正确;②等质量的铝与足量的盐酸、NaOH溶液反应放出的H2物质的量相等,②正确;③等体积等物质的量浓度的盐酸、NaOH溶液与过量的Al反应,产生H2的物质的量不相等,故③错;④铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2;④正确;⑤化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,故⑤错;⑥根据方程式2Na+2H2O===2NaOH+H2↑,可知2 mol Na与足量水反应放出22.4 L氢气,没有状态,无法判断体积;故⑥错;⑦根据离子方程式Mg+2H+===Mg2++H2↑,可知1 molMg与足量H+反应生成1 mol氢气,故⑦错。本题答案:③⑤⑥⑦。
+3H2↑进行判断。①铝和盐酸、NaOH溶液的反应中,铝作还原剂, ①正确;②等质量的铝与足量的盐酸、NaOH溶液反应放出的H2物质的量相等,②正确;③等体积等物质的量浓度的盐酸、NaOH溶液与过量的Al反应,产生H2的物质的量不相等,故③错;④铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2;④正确;⑤化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,故⑤错;⑥根据方程式2Na+2H2O===2NaOH+H2↑,可知2 mol Na与足量水反应放出22.4 L氢气,没有状态,无法判断体积;故⑥错;⑦根据离子方程式Mg+2H+===Mg2++H2↑,可知1 molMg与足量H+反应生成1 mol氢气,故⑦错。本题答案:③⑤⑥⑦。

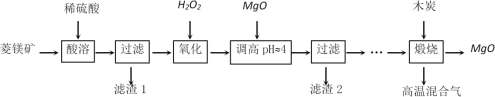
【题目】用软锰矿[主要成分MnO2,还含SiO2 、Fe2O3、Al2O3、Cu2(OH)2CO3的等杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3)生产过程如下

Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | |
开始沉淀时 | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
完全沉淀时 | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
(1)含杂质的软锰矿使用前需将其粉碎,目的是______。
(2)滤渣1中含有的主要物质是_______。
(3)滤液1中,加氨水调控溶液pH至3.2,通入O2,反应的离子方程式是_______。若用H2O2代替O2,是否合理?理由是___________。
(4)软锰矿粉与硫酸和硫酸亚铁溶液反应的离子方程式是_________。
(5)滤液3中加入难溶电解质MnS的目的是(用离子方程式表示)_________。
(6)用重结晶法从滤液4中获取硫酸锰晶体的操作是:__________。