题目内容
【题目】下列对于实验I~IV的说法正确的是( )
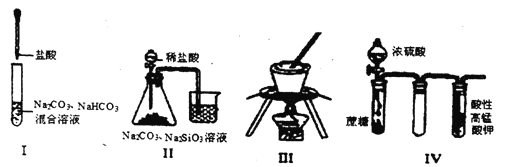
A.实验I:逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验II:可比较氯、碳、硅三种元素的非金属性强弱
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
【答案】D
【解析】A.实验I: 逐滴滴加盐酸时,首先发生反应:Na2CO3+HCl=NaCl+NaHCO3,因此试管中不会立即产生大量气泡,A错误;B.向Na2CO3溶液中加入盐酸,发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,证明酸性:HCl>H2CO3,产生的CO2气体通入Na2SiO3溶液中,发生反应:H2O+CO2+ Na2SiO3= Na2CO3+H2SiO3↓,证明酸性H2CO3> H2SiO3,由于盐酸不是Cl元素的最高价态的含氧酸,且生成的CO2中混有氯化氢,因此不能证明元素的非金属性Cl>C>Si,B错误;C.NaCl的溶解度受温度的影响变化较小,要用蒸发结晶的方法获得晶体,蒸发在蒸发皿中进行,而不能在坩埚中进行,C错误;D.浓硫酸有脱水性、强的氧化性,将蔗糖脱水炭化,产生的碳单质被浓硫酸氧化为CO2,硫酸被还原为SO2,SO2有还原性,容易被酸性KMnO4溶液氧化为硫酸而使溶液的紫色褪色,CO2不能反应,从溶液中逸出。因此会看到装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去,D正确,答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H1-△H2=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取降温措施
