题目内容
【题目】【选修3物质结构】
W、X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子。请回答:
(1)Y基态原子的电子排布式是 ;Y和W形成的三原子分子是 (填“极性”或“非极性”)分子。
(2)X与氢元素可形成的化合物XH3的中心原子杂化轨道类型为 杂化,XY2的立体构型是 。
(3)Z所在周期中第一电离能最大的主族元素Q名称 。比较沸点高低:XY2 ZY。
(4)Z与某元素形成的化合物的晶胞如左下图所示,晶胞中阴离子与阳离子的个数比是 。


(5)R晶胞结构如右上所示,R晶体中每个R原子周围距离最近的R原子数目为 。
【答案】37.(1)1s22s22p4 非极性 (2)sp3 V型
(3)氯 <(或者填“小于”、“低于”) (4)2:1 (5)12
【解析】试题分析:分子式为XY2的红棕色气体为NO2,则X为N元素,Y为O元素,M层与K层电子数相等的基态原子的电子排布式为1s22s22p63s2,则Z为Mg元素,+2价离子的3d轨道上有9个电子的原子的外围电子排布为3d104s1,则R为Cu元素,W是形成有机物种类最多的元素,则W为C元素。
(1)根据上述推断,Y为O元素,O元素基态原子的电子排布式为1s22s22p4;Y和W分别为O、C,O、C形成的三原子分子是CO2,CO2的结构式为O=C=C,该分子正负电荷重心重叠,是非极性分子。
(2) X为N元素,N元素与氢元素形成化合物NH3,根据价层电子对互斥理论可知,在NH3分子中,成键电子对数为3+(5-1×3)÷2=4,所以中心原子杂化轨道类型为sp3杂化;NO2与O3为等电子体,两者结构相似,为V型。
(3)根据上述推断,Z为Mg元素,位于第三周期,同周期元素,从左到右第一电离能逐渐增大,所以Mg所在周期中第一电离能最大的主族元素Q名称氯;XY2为NO2,ZY为MgO,常温常压下,NO2是气体,而MgO是固体,所以沸点高低:NO2< MgO。
(4)由晶胞结构可看出,阳离子位于顶点和体心,阳离子个数=1/8×8+1=2个,阴离子位于面心和体内,阴离子个数=1/2×4+2=4个,阴离子与阳离子个数比为2:1。
(5)根据晶胞结构可知,处于顶点上的粒子,离它最近的粒子位于面心上,则R晶体中每个R原子周围距离最近的R原子数目为3×8÷2=12。

【题目】如图所示,X、Y分别是直流电源的两极,通电后发生a极板质量增加,b极板处有无色无臭气体放出。符合这一情况的是( )
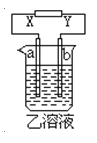
a极板 | b极板 | X电极 | 乙溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
