题目内容
用下列方法测定空气中污染物的含量:将一定体积的空气通入吸收剂,并测定溶液的导电性.如测定空气中H2S的含量;若用CuSO4溶液吸收,可测定很大浓度范围内的H2S,但溶液导电性变化不大,不灵敏;若用浓溴水吸收,只能测定低浓度范围的H2S,但有很高的灵敏度.现要兼顾吸收容量和灵敏度,测定空气中氯气的含量.应选用下列吸收剂中的
[ ]
A.Na2SO3
B.KI溶液
C.NaOH溶液
D.水
答案:A
解析:
提示:
解析:
|
【巧解导析】由题给信息,测定的灵敏度是依据溶液导电性的变化来说明的,而导电性变化是由离子浓度及所带电荷的变化造成的.如H2S和CuSO4反应:CuSO4+H2S=CuS↓+H2SO4,每吸收1mol H2S引起离子数量及电荷的变化是Cu2+, 本题若用Na2SO3吸收Cl2时,反应为:Na2SO3+Cl2+H2O=Na2SO4+2HCl,反应后离子比反应前增加4mol,故灵敏度高;Na2SO3可以很浓,保证吸收容量大,符合要求.用KI吸收Cl2反应为:2KI+Cl2=I2+2KCl,溶液中离子浓度几乎不变.用NaOH吸收Cl2反应为2NaOH+Cl2=NaCl+NaClO,离子浓度也是几乎不变,故灵敏度都不行.用水吸收Cl2,容量和灵敏度都很小. |
提示:
|
【巧解点悟】弄清题给信息的意义,掌握溶液导电能力取决于自由移动离子浓度及离子所带电荷数以及明确反应方程式是解此题的关键. |

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
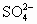 各1mol变为2mol H+和1mol
各1mol变为2mol H+和1mol 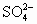 ;导电性变化不大,所以灵敏度不高.而浓溴水吸收H2S的反应为:Br2+H2S=2HBr+S↓,反应后生成强电解质HBr,必然导电性大大增强,故灵敏度高.
;导电性变化不大,所以灵敏度不高.而浓溴水吸收H2S的反应为:Br2+H2S=2HBr+S↓,反应后生成强电解质HBr,必然导电性大大增强,故灵敏度高.