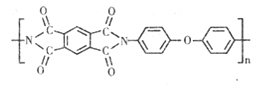
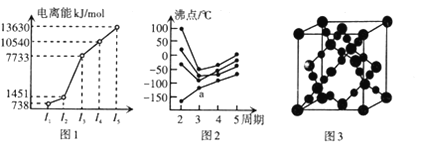
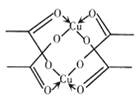
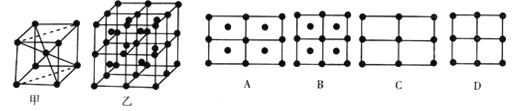
题目内容
【题目】将22.70 g小苏打和纯碱晶体(Na2CO3·10H2O)的混合物分成二等份,取其中一份溶于水,配成200 mL溶液,所得溶液中钠离子的物质的量浓度为0.50 mol·L-1;另一份加热至恒重,则固体质量减少( )
A.6.05 gB.5.35 gC.12.10 gD.16.40 g
【答案】A
【解析】
将Na2CO310H2O与NaHCO3的混合物22.70g溶解于水,将溶液蒸干并加热至质量不变,NaHCO3加热分解生成Na2CO3,最后得到的固体为Na2CO3,根据Na原子守恒,有n(Na2CO3)=![]() n(Na+)=
n(Na+)=![]() ×0.2L×0.50molL-1=0.05mol,所以加热至恒重,则固体Na2CO3质量m(Na2CO3)=0.05mol×106g/mol=5.3g,所以固体质量减少量为:
×0.2L×0.50molL-1=0.05mol,所以加热至恒重,则固体Na2CO3质量m(Na2CO3)=0.05mol×106g/mol=5.3g,所以固体质量减少量为:![]() ×22.70g-5.3g=6.05g,故答案为A。
×22.70g-5.3g=6.05g,故答案为A。

练习册系列答案
相关题目