题目内容
在150℃时,(NH4)2CO3分解的化学方程式为:(NH4)2CO3
2NH3↑+H2O↑+CO2↑,若只有一半碳酸铵分解,产生的气态混合物的密度是相同条件下氢气密度的( )
| △ |
| A、96倍 | B、48倍 |
| C、12倍 | D、10倍 |
考点:铵盐
专题:氮族元素
分析:由方程式可知,生成的混合气体中氨气、水蒸气、二氧化碳的摩尔分数分别为0.5、0.25、0.25,根据平均相对分子质量=Mr1×x1+Mr2×x2+…+Mri×xi计算混合气体平均相对分子质量(其中Mri代表各组分相对分子质量、xi代表各组分摩尔分数),再利用密度之比等于相对分子质量之比计算.
解答:
解:由(NH4)2CO3
2NH3↑+H2O↑+CO2↑可知,1mol(NH4)2CO3分解生成的混合气体中氨气、水蒸气、二氧化碳的摩尔分数分别为0.5、0.25、0.25,则混合气体平均相对分子质量=17×0.5+18×0.25+44×0.25=24,因气体密度之比等于相对分子质量之比,所以混合气的密度是相同条件下的氢气密度的
=12倍,
故选C.
| ||
| 24 |
| 2 |
故选C.
点评:本题结合铵盐的化学性质考查了阿伏伽德罗定律推论应用等,题目难度不大,注意对基础知识的理解掌握,侧重分析能力及计算能力的考查.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
若某原子在处于能量最低状态时,价电子排布为4d15s2,则下列说法正确的是( )
| A、该元素原子处于能量最低状态时,原子中共有3个未成对电子 |
| B、该元素原子核外共有5个能级 |
| C、该元素原子的M能层共有18个电子 |
| D、该元素原子最外能层共有3个电子 |
在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知vB=3vA、3vC=2vB,则此反应可表示为( )
| A、2A+3B=2C |
| B、A+3B=2C |
| C、3A+B=2C |
| D、A+B=C |
下列各对物质中属于同分异构体的是( )
| A、金刚石与石墨 |
| B、O2与O3 |
C、 和 和 |
D、 与 与 |
日本福岛核电站泄漏物中含有放射性的
I.有关
I的说法不正确是( )
131 53 |
131 53 |
A、与
| ||
| B、中子数为78 | ||
C、与
| ||
| D、质量数为131 |
用下列装置进行相应实验,能达到实验目的是( )
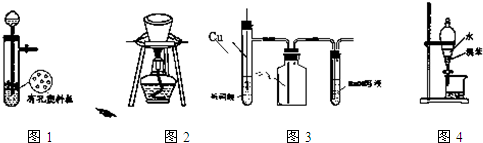

| A、图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 |
| B、图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠 |
| C、图3所示装置用于制备并收集NO气体 |
| D、图4所示装置用于分离出溴苯 |
下列各组元素中按微粒半径递增顺序排列的是( )
| A、Li、Na、K |
| B、Ba2+、Ca2+、Mg2+? |
| C、Ca2+、K+、Cl- |
| D、N、O、F |
下列分子中,原子的最外层电子不能都满足8电子稳定结构的是( )
| A、CCl4 |
| B、SF6 |
| C、CS2 |
| D、PCl3 |
下图表示治理汽车尾气所涉及反应的微观过程.下列说法不正确的是( )


| A、图中单质的化学式为N2 |
| B、该反应使有害气体转化为无害气体 |
| C、该反应属于置换反应 |
| D、生成单质与化合物的质量比为7:22 |