题目内容
(07年北京卷) 有 ① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol?L-1,下列说法正确的是()
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol?L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
答案:C
解析:盐的水解是历年高考命题的热点之一,考察的主要形式有:影响盐水解的因素、水解的离子方程式、离子共存问题、离子浓度大小比较、水解平衡的移动等,其中具体的热点题型是离子共存问题、离子方程式正误判断以及离子浓度的大小比较等,在近几年的高考试题中保持了相当高的连续性和稳定性。由于水解涉及面较广,除了热点考查外,还可以将盐的水解知识与其他知识有机地结合在一起考查,例如本题就将盐的水解与弱电解质的电离、酸碱中和、pH等知识融合在一起。针对这一特点,在备考复习时一方面要熟练掌握有关的基础知识,另一方面要强化训练以形成一定的解题能力。

(07年北京卷)(15分)北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 |
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 _______ 。
②b中反应所产生的I2的物质的量是_______ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_________mg/kg。
(07年北京卷)(13分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
 |
已知: a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是_______ 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
 |
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式)。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是 ___________ 。
(07年北京卷)(15分)碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子氢原子个数为氧的5倍。
(1)A的分子式是_____ 。
(2)A有2个不同的含氧官能团,其名称是__________ 。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是__________ 。
②A不能发生的反应是(填写序号字母)_________。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(4)写出两个与A具有相同官能团、并带有支链的同分异构体的结构简式是_____、_________ 。
(5)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是________ 。
(6)已知环氧氯丙烷可与乙二醇发生如下聚合反应:
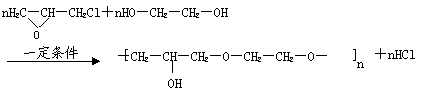 |
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构式是____________________ 。