题目内容
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
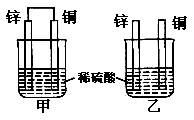

| A.两烧杯中铜片表面均有气泡产生 |
| B.甲烧杯中的电流与阳离子流向均为Zn→Cu |
| C.两烧杯中溶液的pH均增大 |
| D.两烧杯在相同时间内转移电子数相等 |
C
试题分析:甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析。
A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B、甲烧杯中的电流流向均为Cu→Zn,故B错误;
C、甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,因此pH均增大,故C正确.
D、甲装置形成了原电池,反应速率会加快,因此甲比乙在相同时间内转移的电子数要多,故D错误.
故选C。
点评:题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
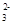 +7H2O
+7H2O
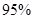 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) 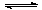 NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是 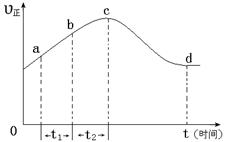
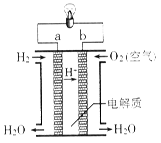
 2H2O
2H2O
 CO2(g)+2H2O(1);△H<0
CO2(g)+2H2O(1);△H<0