题目内容
(14分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
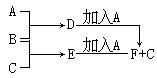
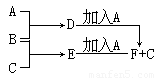
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)______________ , ______________ , _______________。
(3)以下各小题均为常温下的溶液
j某溶液中由水电离的c(H+)=10-10mol·L-1,则该溶液的pH为__________。
k盐类水解的逆反应是中和反应 (填“对”或“错”)
lHCO3—溶液呈碱性说明HCO3—的电离能力弱于水解能力 (填“对”或“错”)
m盐溶液显酸碱性,一定是由水解引起的 (填“对”或“错”)
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)  Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 ml蒸馏水 ②100 mL 0.3 mol·lL-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为_______________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
(1)c(NH4+)>c(SO42—)>c(H+)>c(OH-)
(2)HCO3— H++CO32—;HCO3—+H2O
H++CO32—;HCO3—+H2O H2CO3+OH-;H2O
H2CO3+OH-;H2O H++OH-
H++OH-
(3) 4或10 ,对,对,错 (4)②①③ 6×10-10mol·L-1
解析试题分析:(1)硫酸铵是强酸弱碱盐,NH4+水解,溶液显酸性,所以离子浓度大小顺序是c(NH4+)>c(SO42—)>c(H+)>c(OH-)。
(2)碳酸氢钠是弱酸的酸式盐,存在电离平衡、水解平衡以及水的电离平衡,即HCO3— H++CO32—;HCO3—+H2O
H++CO32—;HCO3—+H2O H2CO3+OH-;H2O
H2CO3+OH-;H2O H++OH-。
H++OH-。
(3)①某溶液中由水电离的c(H+)=10-10mol·L-1,则该溶液中水的电离是被抑制的,因此可能是酸或碱,因此溶液的pH=4或10。
②盐类水解可以看作是中和反应的逆反应。
③HCO3—的水解程度大于HCO3—的电离程度,所以碳酸氢钠溶液显碱性。
④硫酸氢钠溶于水电离出氢离子,溶液显酸性,但硫酸氢钠不水解,所以盐溶液显酸碱性,一定是由水解引起的,是错误的。
(4)根据氯化银的溶度积常数可知,氯离子浓度越大,银离子浓度就越小,所以Ag+浓度由大到小的顺序为②①③。Ag+浓度是0.3mol/L,所以氯离子浓度是1.8×10-10÷0.3=6×10-10mol·L-1。
考点:考查溶液中离子浓度大小比较、水解平衡、电离平衡、溶解平衡的有关应用和判断等
点评:化学平衡、电离平衡、水解平衡、溶解平衡等都是动态平衡,适用于勒夏特例原理,据此可以进行有关判断。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(其中(1)题每空1分,(2)、(3)、(4)每空2分,共14分)
现有下列十种物质:①NH3 ②铁 ③Ba(OH)2 ④CO2 ⑤H2SO4 ⑥NaOH ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
|
分类标准 |
|
氧化物 |
|
|
电解质 |
非电解质 |
|
属于该类的物质 |
② |
|
⑧ ⑨ |
⑦ |
|
|
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-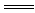 H2O,该离子反应对应的化学方程式(写一个)为
H2O,该离子反应对应的化学方程式(写一个)为
(3)⑩在水中的电离方程式为 ,17.1 g ⑩溶于水配成250mL溶液,SO42-的物质的量浓度为 。
(4)将④通入⑥的溶液中反应的离子方程为 。