题目内容
实验室制取乙烯时,常因温度过高而发生副反应。完成下列问题:
(1)写出实验室制取乙烯的化学方程式:______________________。
(2)较高温度下,乙醇与浓H2SO4反应生成了CO2、SO2、H2O,写出并配平此副反应:________________,反应过程中,混合液颜色加深,变黄、变黑,证明___________________。
(3)请用下图中编号为①②③④的装置设计一个实验,以验证乙烯的性质和上述混合气体中含有CO2、SO2和水蒸气。用装置的编号表示装置的连接顺序(按产物气流从左到右):________→________→________→________。

(4)装置①中A瓶的现象是___________________,原因是______________________;B瓶的作用是______________________;确证乙烯存在的现象是______________________。
(5)装置③中加的固体药品是________,以验证混合气体中含有________;装置②中盛的溶液是________,以验证混合气体中的________。
(6)装置①在整套装置中所放位置的理由是_________________________________________。
(1)写出实验室制取乙烯的化学方程式:______________________。
(2)较高温度下,乙醇与浓H2SO4反应生成了CO2、SO2、H2O,写出并配平此副反应:________________,反应过程中,混合液颜色加深,变黄、变黑,证明___________________。
(3)请用下图中编号为①②③④的装置设计一个实验,以验证乙烯的性质和上述混合气体中含有CO2、SO2和水蒸气。用装置的编号表示装置的连接顺序(按产物气流从左到右):________→________→________→________。

(4)装置①中A瓶的现象是___________________,原因是______________________;B瓶的作用是______________________;确证乙烯存在的现象是______________________。
(5)装置③中加的固体药品是________,以验证混合气体中含有________;装置②中盛的溶液是________,以验证混合气体中的________。
(6)装置①在整套装置中所放位置的理由是_________________________________________。
(1)CH3CH2OH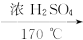 CH2==CH2↑+H2O
CH2==CH2↑+H2O
(2)C2H5OH+6H2SO4(浓)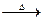 2CO2↑+6SO2↑+9H2O 还有部分乙醇被浓H2SO4氧化成单质炭
2CO2↑+6SO2↑+9H2O 还有部分乙醇被浓H2SO4氧化成单质炭
(3)④ ③ ① ②
(4)品红溶液褪色 混合气体中含SO2 检验SO2是否除净 B瓶中品红不褪色,而C瓶中溴水褪色
(5)无水CuSO4 水蒸气 澄清石灰水 CO2
(6)装置①不能放在③之前,因气流通过①会带出水蒸气,影响H2O的确证;装置①不能放在②之后,因为SO2亦能使澄清石灰水变浑浊,影响CO2的确证
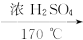 CH2==CH2↑+H2O
CH2==CH2↑+H2O(2)C2H5OH+6H2SO4(浓)
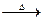 2CO2↑+6SO2↑+9H2O 还有部分乙醇被浓H2SO4氧化成单质炭
2CO2↑+6SO2↑+9H2O 还有部分乙醇被浓H2SO4氧化成单质炭(3)④ ③ ① ②
(4)品红溶液褪色 混合气体中含SO2 检验SO2是否除净 B瓶中品红不褪色,而C瓶中溴水褪色
(5)无水CuSO4 水蒸气 澄清石灰水 CO2
(6)装置①不能放在③之前,因气流通过①会带出水蒸气,影响H2O的确证;装置①不能放在②之后,因为SO2亦能使澄清石灰水变浑浊,影响CO2的确证
(1)C2H5OH和浓H2SO4发生氧化还原反应,C2H5OH中C的平均化合价为-2,根据化合价升降总值相等,可配平方程式。
(2)要证明乙烯的性质并检验含杂质CO2、SO2、H2O,应先检验H2O(否则后续实验会带入水蒸气),然后检验SO2,再检验除净SO2(防止SO2对C2H4性质干扰和对CO2检验的干扰),再验证C2H4的性质,最后检验CO2气体。SO2干扰反应如下:SO2+Br2+2H2O====H2SO4+2HBr(使溴水亦褪色),SO2+Ca(OH)2====CaSO3↓+H2O(亦使澄清石灰水变浑浊)。
(3)检验水应用无水CuSO4粉末;检验SO2和检验SO2是否除净用品红溶液,检验C2H4用溴水,检验CO2用澄清石灰水。
(2)要证明乙烯的性质并检验含杂质CO2、SO2、H2O,应先检验H2O(否则后续实验会带入水蒸气),然后检验SO2,再检验除净SO2(防止SO2对C2H4性质干扰和对CO2检验的干扰),再验证C2H4的性质,最后检验CO2气体。SO2干扰反应如下:SO2+Br2+2H2O====H2SO4+2HBr(使溴水亦褪色),SO2+Ca(OH)2====CaSO3↓+H2O(亦使澄清石灰水变浑浊)。
(3)检验水应用无水CuSO4粉末;检验SO2和检验SO2是否除净用品红溶液,检验C2H4用溴水,检验CO2用澄清石灰水。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
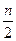
 C2H6+C2H4;C4H10
C2H6+C2H4;C4H10