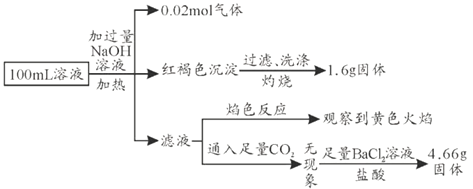
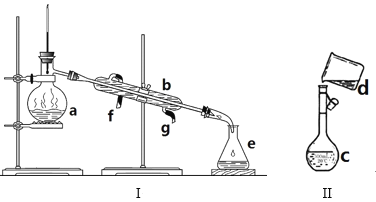
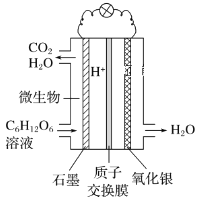
题目内容
【题目】燃煤烟气中含有SO2和NOx(主要成分为NO和NO2的混合物),烟气的脱硫、脱硝技术是环境科学研究的热点。完成下列填空
(1)烟气脱硫、脱硝的环境意义是________________________________。
(2)液相氧化法采用碱性NaClO2溶液作为吸收剂,如脱除NO的原理为:____NaOH + ____NaClO2 + ____NO → ____NaNO3 + ____NaCl + ____H2O配平上述化学方程式。该反应中被还原的元素是_______________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的脱除效果。如脱除SO2的原理为:ClO- + SO2 + H2O=Cl-+ SO42- + 2H+。结合平衡移动原理分析使用Ca(ClO)2脱硫效果为何较NaClO更好?____。
【答案】防止酸雨的发生 4 3 4 4 3 2 Cl 形成CaSO4沉淀,降低硫酸根离子浓度,反应平衡向产物方向移动,SO2转化率提高;
【解析】
(1)硫、氮的氧化物会污染空气;
(2)根据电子守恒和元素守恒配平反应方程式;
(3)脱硫效果好即需要平衡右移,据此分析。
(1)烟气脱硫、脱硝可以降低硫的氧化物、氮的氧化物含量,防止酸雨的发生,故答案为:防止酸雨的发生;
(2)该反应中Cl元素由+3价降到-1价,化合价降低被还原,做氧化剂,N元素由+2价升高到+5价,化合价升高被氧化,做还原剂,根据电子守恒和元素守恒可知方程式为:![]() ,故答案为:4;3;4;4;3;2;Cl;
,故答案为:4;3;4;4;3;2;Cl;
(3)①如果采用NaClO、Ca(ClO)2替代NaClO2,生成硫酸钙沉淀,降低硫酸根离子浓度,促使平衡向正反应方向进行,所以Ca(ClO)2效果好,故答案为:形成CaSO4沉淀,降低硫酸根离子浓度,反应平衡向产物方向移动,SO2转化率提高;

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案