题目内容
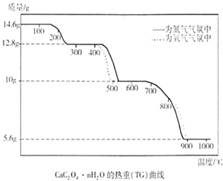
热重分析法是程序控制温度下,测量物质的质量与温度的关系的一种实验技术.现有一CaC2O4?nH2O试样,分别在氮气气氛、氧气气氛中进行热重分析,得到如下热重(TG)曲线.(1)图中曲线上有三个失重台阶,分别表示加热过程中依次发生了三个反应.根据第1步反应的失重数据计算试样CaC2O4?nH2O中的n值(精确到整数)为 .
(2)根据第2步反应的失重数据推测第2反应的化学方程式为 ;观察曲线说明氧气存在时有利于第2步反应进行,原因是 .
(3)第3步反应中释放的气体产物是 .观察曲线可判断出,氧气存在时不利于第3步反应进行,可能原因是 .

(2)第2步反应为CaC2O4分解生成CaCO3与碳的氧化物,根据质量守恒计算生成氧化物的质量,在根据碳原子守恒确定氧化物的物质的量,进而确定该碳的氧化物的相对分子质量,确定分子式,据此书写;
(3)第3步,继续加热固体,碳酸钙分解生成氧化钙和二氧化碳,第2步时,在氧气氛围内,一氧化碳和氧气反应生成的二氧化碳抑制碳酸钙分解.
解答:解:(1)根据图象可知第1步反应是晶体失去结晶水的过程,14.6克CaC2O4?xH2O失去水后生成12.8克CaC2O4,则:
CaC2O4?xH2O~CaC2O4,
128+18x 128
14.6g 12.8g
所以:(128+18x):128=14.6g:12.8g,解得x=1,
故答案为:1;
(2)第2步生成氧化物的质量=12.8g-10g=2.8g,12.8克CaC2O4的物质的量=
 =0.1mol,根据钙原子守恒知,生成碳酸钙的物质的量是0.1mol,根据碳原子守恒知,生成氧化物的物质的量是0.1mol,氧化物的相对分子质量=
=0.1mol,根据钙原子守恒知,生成碳酸钙的物质的量是0.1mol,根据碳原子守恒知,生成氧化物的物质的量是0.1mol,氧化物的相对分子质量= =28g/mol,则该氧化物是CO,所以其反应方程式为:CaC2O4
=28g/mol,则该氧化物是CO,所以其反应方程式为:CaC2O4 CaCO3+CO↑;
CaCO3+CO↑;草酸钙的分解中生成一氧化碳,一氧化碳和氧气反应生成二氧化碳,从而促使草酸钙的分解向正反应方向移动,
故答案为:CaC2O4
 CaCO3+CO↑;一氧化碳和氧气反应生成二氧化碳,从而促使草酸钙的分解向正反应方向移动;
CaCO3+CO↑;一氧化碳和氧气反应生成二氧化碳,从而促使草酸钙的分解向正反应方向移动;(3)第3步,继续加热固体,碳酸钙分解生成氧化钙和二氧化碳,CaCO3
 CaO+CO2↑,
CaO+CO2↑,第2步时,在氧气氛围内,第2步产生的一氧化碳和氧气反应生成的二氧化碳,第2步产生的二氧化碳抑制碳酸钙分解,所以氧气存在时不利于第3步反应进行,
故答案为:CO2;氧气存在时第2步反应产生二氧化碳会抑制碳酸钙分解反应的进行.
点评:本题考查物质的量的有关计算及物质的确定,明确图象中曲线拐折的含义是解本题的关键,再结合原子守恒、物质之间的关系式来分析解答即可,难度较大.

下面是测定硫酸钢晶体中结晶水含量的实验,请按要求填空。
(1)加热前应将晶体放在 中研碎,放在 中进行加热,加热失水后,应放在 中冷却。
(2)判断是否完全失去结晶水的方法是 (定性和定量)。热重分析法是通过在一定程序控制的温度下,测定物质的质量与温度关系的一种实验技术,该技术使用的关键仪器是热重分析仪,其基本构造如图所示,记录仪画出质量…炉温曲线,又称热重曲线。

近年来有人对![]() 的加热分解作了进一步研究,发现
的加热分解作了进一步研究,发现![]() 分解为CuO之前还有一黄色物质A产生,A的相对分子质量为239。3mol A与4mol水反应生成lmol蓝色固体B和2mol
分解为CuO之前还有一黄色物质A产生,A的相对分子质量为239。3mol A与4mol水反应生成lmol蓝色固体B和2mol ![]() ,B的化学式可表示为
,B的化学式可表示为![]() 。将物质B进行热重分析,其结果如下表所示。
。将物质B进行热重分析,其结果如下表所示。
| 温度 | 25 | 60 | 412 | 690 | 1480 |
| 加热前/mg | 94.1 | 94.1 | 90.4 | 79.7 | 63.6 |
(3)取一定质量的试样进行实验,即使质量不变,当温度升高时,天平显示出的试样质量也有微弱的增加,这种现象称为“表观增重”,其原因是温度升高 。
A.样品体积增大,密度减小
B.气体密度减小,浮力减小
C.地球对样品的吸引力增大
(4)黄色物质A的化学式(写成氧化物的形式)是 。
(5)蓝色固体B在60℃之前质量不变,这一现象说明 。
蓝色固体B在412~690℃之间发生反应的化学方程式为
(6)如果表中的质量数据未经估读,则该精密天平的精度是托盘天平(最小刻度为0.1g)精度的 倍。
 (2012?杭州一模)热重分析法是程序控制温度下,测量物质的质量与温度的关系的一种实验技术.现有一CaC2O4?nH2O试样,分别在氮气气氛、氧气气氛中进行热重分析,得到如下热重(TG)曲线.
(2012?杭州一模)热重分析法是程序控制温度下,测量物质的质量与温度的关系的一种实验技术.现有一CaC2O4?nH2O试样,分别在氮气气氛、氧气气氛中进行热重分析,得到如下热重(TG)曲线.