题目内容
【题目】将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
A. 若c1=2c2,则w1<2w2,V<50 mL
B. 若c1=2c2,则w1<2w2,V>50 mL
C. 若w1=2w2,则c1<2c2,V=50 mL
D. 若w1=2w2,则c1>2c2,V<50 mL
【答案】A
【解析】试题分析:A、B、设物质的量是浓度为c1molL﹣1的密度为ρ1,物质的量是浓度为c2molL﹣1硫酸溶液的密度为ρ2,利用c=![]() 公式变形计算硫酸的质量分数,结合硫酸溶液的浓度越大密度越大,进行判断;
公式变形计算硫酸的质量分数,结合硫酸溶液的浓度越大密度越大,进行判断;
稀释前后溶质的质量不变,结合质量分数关系,判断稀释后溶液的质量小于100g,故水的质量小于50g,据此判断水的体积;
C、D、根据稀释前后溶质的质量不变计算混合后溶液的质量为100g,计算水的质量为50g,据此计算水的体积;
设物质的量是浓度为c1molL﹣1的密度为ρ1,物质的量是浓度为c2molL﹣1硫酸溶液的密度为ρ2,利用c=![]() 计算硫酸的浓度,结合浓硫酸溶液的浓度越大密度越大,进行判断.
计算硫酸的浓度,结合浓硫酸溶液的浓度越大密度越大,进行判断.
解:A、若c1=2c2,设物质的量是浓度为c1molL﹣1的密度为ρ1,物质的量是浓度为c2molL﹣1硫酸溶液的密度为ρ2,则:ω1=![]() ,ω2=
,ω2=![]() ,所以
,所以![]() =
=![]() =
=![]() ,浓硫酸的浓度越大密度越大,则ρ1>ρ2,故ω1<2ω2,稀释前后溶质的质量不变,所以稀释后溶液的质量小于100g,故水的质量小于50g,水的密度为1g/ml,所以水的体积V<50ml;故A正确;
,浓硫酸的浓度越大密度越大,则ρ1>ρ2,故ω1<2ω2,稀释前后溶质的质量不变,所以稀释后溶液的质量小于100g,故水的质量小于50g,水的密度为1g/ml,所以水的体积V<50ml;故A正确;
B、由A分析可知,所以水的体积V<50ml,ω1<2ω2,故B错误;
C、稀释前后溶质的质量不变,若ω1=2ω2,则稀释后溶液的质量为100g,所以水的质量为50g,水的密度为1g/ml,所以水的体积V=50ml;设物质的量是浓度为c1molL﹣1的密度为ρ1,物质的量是浓度为c2molL﹣1硫酸溶液的密度为ρ2,则:c1=![]() ,c2=
,c2=![]() ,所以
,所以![]() =
=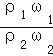 =
=![]() ,浓硫酸的浓度越大密度越大,则ρ1>ρ2,故c1>2c2,故C错误;
,浓硫酸的浓度越大密度越大,则ρ1>ρ2,故c1>2c2,故C错误;
D、由C中分析可知,水的体积V=50ml,c1>2c2,故D错误.故选:A.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案