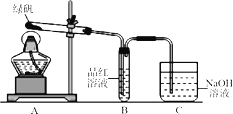
��Ŀ����
����Ŀ��ͼΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��û�ѧ����ش��������⣺
�� ���� | IA | 0 | ||||||
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | ||||
��1��������Ԫ�ص�����������Ӧ��ˮ�����У�����ǿ�����________���û�ѧʽ��ʾ����ͬ����������ǿ����________��
��2���ܡ��ݡ��ļ����Ӱ뾶�ɴ�С��˳����________�������ӷ��ţ���
��3���ɢ١��ܡ��ݡ�����Ԫ����ɵĻ������л�ѧ���������У�________��
��4����д���漰�����й�Ԫ�ص������û���Ӧ��Ҫ��ͬһ��Ӧ�����ֵ��ʶ�ӦԪ�ؼȲ�ͬ����Ҳ��ͬ���壩________��__________��
��5���ɱ���Ԫ���γɵij�����������A��B��C��X������ת����ϵ��
A![]() B
B![]() C
C
��A��B��C��ͬһ����Ԫ�أ�XΪǿ����ʣ��ҷ�Ӧ������Һ�н��У�B�Ļ�ѧʽΪ______����Ӧ�ķ�Ӧ�ٵ����ӷ���ʽΪ________��
���𰸡� H2SO4��HNO3 NaOH O2����Na+��Al3+ ���Ӽ������ۼ� C+H2O(g)![]() CO+H2 2Al+3H2SO4��Al2(SO4)3+3H2�� Al��OH��3 Al3++3OH��=Al��OH��3����Al��OH��4����+H+=Al��OH��3��+H2O
CO+H2 2Al+3H2SO4��Al2(SO4)3+3H2�� Al��OH��3 Al3++3OH��=Al��OH��3����Al��OH��4����+H+=Al��OH��3��+H2O
������������Ԫ�������ڱ��е�λ�ã��жϳ�Ԫ�أ�Ȼ����Ԫ���������Լ�������ʵ����ʷ����жϡ�
����Ԫ�آ������ڱ��е�λ�ÿ��жϣ����Ƿֱ���H��C��N��O��Na��Al��Si��S����
��1��������Ԫ�ص�����������Ӧ��ˮ����������ǿ�����HNO3��H2SO4��������ǿ����NaOH��
��2���ܡ��ݡ��ļ����ӵĺ�������Ų���ͬ�������Ӱ뾶��ԭ���������������С����뾶�ɴ�С��˳����O2-��Na+��Al3+��
��3���ɢ١��ܡ��ݡ�����Ԫ����ɵĻ��������������ƣ����л�ѧ�������������Ӽ������ۼ���
��4������Ԫ�ؿ�֪�ܷ������û���Ӧ��C+H2O(g)![]() CO+H2��2Al+3H2SO4��Al2(SO4)3+3H2����
CO+H2��2Al+3H2SO4��Al2(SO4)3+3H2����
��5����A��B��C��ͬһ����Ԫ�أ�XΪǿ����ʣ��ҷ�Ӧ������Һ�н��У���ý���Ӧ����Al��B�������������仯ѧʽΪAl(OH)3��A���������λ�ƫ�����Σ����Ӧ�ķ�Ӧ�ٵ����ӷ���ʽΪAl3++3OH-=Al(OH)3����Al(OH)4��-+H+=Al(OH)3��+H2O��

����Ŀ�����и������ʷ�����ȷ����
�� | �� | �� | ������ | |
A | ���� | ���� | ������ | �ɱ� |
B | ���� | �ռ� | ���� | ����ͭ |
C | ̼�� | ��ʯ�� | С�մ� | �������� |
D | ������̼ | ������ | ʳ�� | ʯ��ʯ |
A.AB.BC.CD.D