题目内容
每年由于腐蚀造成的钢铁损失约占年产量的10-20%,金属的防腐十分重要.钢铁防腐方法有许多种,图-1与图-2是两个典型的例子.对其中原理的描述正确的是( )


| A、图-1:a为电源正极 |
| B、图-1:辅助电极上的反应:O2+4e+2H2O→4OH- |
| C、图-2:电子流动方向d→c |
| D、图-2:金属A可以是耐腐蚀的金属铜 |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:A、Fe作阴极被保护;
B、辅助电极为阳极,氢氧根离子放电;
C、活泼性比Fe强的金属作负极,电子从金属A流向Fe;
D、金属A作负极被腐蚀.
B、辅助电极为阳极,氢氧根离子放电;
C、活泼性比Fe强的金属作负极,电子从金属A流向Fe;
D、金属A作负极被腐蚀.
解答:
解:A、Fe作阴极被保护,所以Fe与外接电源的负极相连,则a为负极,故A错误;
B、辅助电极为阳极,氢氧根离子放电,则辅助电极上的反应:4OH--4e-→O2↑+2H2O,故B错误;
C、活泼性比Fe强的金属作负极,电子从金属A流向Fe,所以电子流动方向d→c,故C正确;
D、金属A作负极被腐蚀,则金属A的活泼性比铁强,所以A不能是铜,故D错误.
故选C.
B、辅助电极为阳极,氢氧根离子放电,则辅助电极上的反应:4OH--4e-→O2↑+2H2O,故B错误;
C、活泼性比Fe强的金属作负极,电子从金属A流向Fe,所以电子流动方向d→c,故C正确;
D、金属A作负极被腐蚀,则金属A的活泼性比铁强,所以A不能是铜,故D错误.
故选C.
点评:本题考查学生金属的腐蚀和防护知识,注意把握金属的腐蚀原理和防护方法,注意基本概念的理解和掌握是关键,难度不大.

练习册系列答案
相关题目
航天科学技术测得,三氧化二碳(C2O3)是金星大气层的成分之一.下列有关C2O3的说法正确的是( )
| A、C2O3和CO2可看成CO和CO2组成的混合物 |
| B、C2O3可能在氧气中燃烧 |
| C、C2O3和CO都是酸性氧化物 |
| D、C2O3的结构式可能为O=C=O=C=O |
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是 ( )
| A、Na+、K+、Cl-、SO42- |
| B、Na+、Cu2+、SO42-、NO3- |
| C、Mg2+、NH4+、SO42-、Cl- |
| D、K+、Ba2+、MnO4-、NO3- |
下列说法错误的是( )
| A、现代化学分析测试中用原子吸收光谱确定物质中含有哪些金属元素 |
| B、海水中碘的总藏量很大,所以工业上直接由海水提取碘 |
| C、稀的硫酸铜溶液可用于治疗鱼类皮肤病和鳃病 |
| D、早在1000多年前,我国就已采用加热绿矾的方法制取硫酸 |
 从松树中分离得到的松柏醇,其结构简式如图所示,它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2和HBr的最大用量分别是( )
从松树中分离得到的松柏醇,其结构简式如图所示,它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2和HBr的最大用量分别是( )| A、1 mol,2 mol |
| B、4 mol,2 mol |
| C、4 mol,4 mol |
| D、4 mol,1 mol |
下列除杂方法正确的是( )
| A、用氢气除去乙烷中混有的少量乙烯 |
| B、用金属钠除去乙醇中混有的少量水 |
| C、用酸性高锰酸钾溶液除去甲烷中混有的少量乙烯 |
| D、用饱和碳酸氢钠溶液除去二氧化碳中混有的少量氯化氢 |
已知:①氯元素有两种同位素:
Cl和
Cl
②反应:KClO3+6HCl═KCl+3Cl2↑+3H2O
现用K35ClO3与H37Cl两种物质反应制取Cl2,所制得的Cl2中分子的相对分子质量不可能出现的数值有( )
35 17 |
37 17 |
②反应:KClO3+6HCl═KCl+3Cl2↑+3H2O
现用K35ClO3与H37Cl两种物质反应制取Cl2,所制得的Cl2中分子的相对分子质量不可能出现的数值有( )
| A、71 | B、72 | C、73 | D、74 |
某电化学实验装置如图所示,下列说法正确的是( )
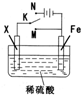

| A、若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极 |
| B、若X为碳棒,开关K置于N处,转移0.2mol e-时析出0.1mol O2 |
| C、若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀 |
| D、若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e-=Zn2+ |