题目内容
【题目】将在空气中暴露一段时间后的氢氧化钠固体样品溶于水得溶液A,将所得溶液中遂滴滴加稀硫酸至过量,生成的二氧化碳体积(标准状况下)与加入稀硫酸体积关系如图所示。
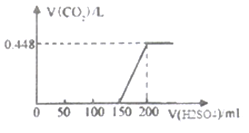
(1)溶液A中滴加硫酸的体积在0-150mL间无CO2气体生成的原因是(用化学方程式表示)_________________________________________________________;
(2)硫酸滴加至150mL时溶波中溶质主要成分为(写化学式)_______________;
(3)溶液A中碳酸钠的质量为____g;
(4)硫酸的物质的量浓度为______mol/L。
(5)该样品中Na2CO3与NaOH物质的量之比为________。
【答案】 2NaOH+H2SO4=Na2SO4+2H2O, 2Na2CO3+H2SO4=Na2SO4+2NaHCO3 Na2SO4和NaHCO3 2.12 0.2 1:2
【解析】本题考查碳酸钠与盐酸反应的计算,(1)氢氧化钠暴露一段时间后,以及根据图像,溶液A中的溶质为NaOH和Na2CO3,0-150mL,发生的反应是2NaOH+H2SO4=Na2SO4+2H2O, 2Na2CO3+H2SO4=Na2SO4+2NaHCO3;(2)根据(1)150mL时,溶质为Na2SO4和NaHCO3;(3)根据碳元素守恒,n(Na2CO3)=n(CO2)=0.448/22.4mol=0.02mol,质量为0.02×106g=2.12g;(4)150-200mL之间,发生HCO3-+H+=H2O+CO2↑,消耗的硫酸的物质的量为0.448/(22.4×2)mol=0.01mol,即硫酸物质的量浓度为0.01/(50×10-3)mol·L-1=0.2mol·L-1;(5)0-150mL,发生的反应是2NaOH+H2SO4=Na2SO4+2H2O, 2Na2CO3+H2SO4=Na2SO4+2NaHCO3,碳酸钠的物质的量为0.02mol,消耗硫酸的物质的量为0.01mol,0-150mL,消耗硫酸的总物质的量为150×10-3×0.2mol=0.03mol,即NaOH物质的量为(0.03-0.01)×2mol=0.04mol,碳酸钠与NaOH物质的量之比为0.02:0.04=1:2。