题目内容
3.铜的冶炼大致可分为:①富集,将硫化物矿进行浮选;
②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2═2Cu2O+2SO2,2Cu2O+Cu2S═6Cu+SO2↑;
④电解精炼铜.
下列说法不正确的是( )
| A. | 上述灼烧过程的尾气回收后可用来制硫酸 | |
| B. | 上述过程中,由6 mol CuFeS2制取6 mol Cu时共消耗15 mol O2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 1200℃灼烧Cu2S得Cu2O而不是CuO,可能是高温下+1价铜更稳定 |
分析 A.尾气中含有二氧化硫,二氧化硫是制取硫酸的主要成分;
B.②中6 mol CuFeS2完全反应生成3molCu2S,消耗12mol氧气,③中将两个方程式相加得3Cu2S+3O2═6Cu+3SO2,3molCu2S完全反应生成Cu消耗3mol氧气;
C.在反应2Cu2O+Cu2S═6Cu+SO2↑中,Cu元素化合价由+1价变为0价、S元素化合价由-2价变为+4价,得电子化合价降低的反应物是氧化剂;
D.只有稳定性强的物质才能长久存在.
解答 解:A.二氧化硫是制取硫酸的主要成分,尾气中含有二氧化硫,所以灼烧过程的尾气回收后可用来制硫酸,故A正确;
B.②中6 mol CuFeS2完全反应生成3molCu2S,消耗12mol氧气,③中将两个方程式相加得3Cu2S+3O2═6Cu+3SO2,3molCu2S完全反应生成Cu消耗3mol氧气,所以总共消耗氧气物质的量为15mol,故B正确;
C.在反应2Cu2O+Cu2S═6Cu+SO2↑中,Cu元素化合价由+1价变为0价、S元素化合价由-2价变为+4价,得电子化合价降低的反应物是氧化剂,所以Cu2O、Cu2S都是氧化剂,故C错误;
D.只有稳定性强的物质才能长久存在,所以1200℃灼烧Cu2S得Cu2O而不是CuO,可能是高温下+1价铜更稳定,故D正确;
故选C.
点评 本题以铜的冶炼为载体考查氧化还原反应,侧重考查基本概念及方程式的有关计算,正确书写③的总化学方程式是解本题关键,题目难度不大.

练习册系列答案
相关题目
11.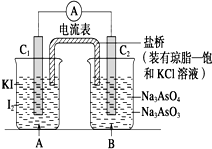 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40%NaOH溶液
结果发现电流表指针均发生偏转.据此,下列判断正确的是( )
 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40%NaOH溶液
结果发现电流表指针均发生偏转.据此,下列判断正确的是( )
| A. | 操作Ⅰ过程中,C1为正极 | |
| B. | 操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 | |
| C. | Ⅰ操作过程中,C2棒上发生的反应为AsO${\;}_{4}^{3-}$+2H++2e-=AsO${\;}_{3}^{3-}$+H2O | |
| D. | Ⅱ操作过程中,C1棒上发生的反应为2I--2e-=I2 |
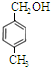
18.某有机物的结构简式为 ,它在一定条件下可能发生的反应( )
,它在一定条件下可能发生的反应( )
①加成;②水解;③取代;④氧化;⑤中和;⑥消去;⑦还原;⑧加聚.
 ,它在一定条件下可能发生的反应( )
,它在一定条件下可能发生的反应( )①加成;②水解;③取代;④氧化;⑤中和;⑥消去;⑦还原;⑧加聚.
| A. | ①③④⑤⑥⑦⑧ | B. | ①③④⑤⑦⑧ | C. | ①③⑤⑥⑦ | D. | ②③④⑤⑥ |
12.下列纯净物中既能跟氢气反应,又能跟高锰酸钾溶液反应,但既不能跟溴水发生加成反应,又不能发生加聚反应的是( )
| A. | 裂化汽油 | B. | 直馏汽油 | C. | 甲苯 | D. | 苯 |
13.下列说法中错误的是( )
| A. | 卤化氢中,以HF沸点最高,是由于HF分子间存在氢键 | |
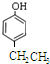
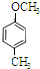
| B. | 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 | |
| C. | N2分子中有一个σ键,2个π键 | |
| D. | 在元素周期表中,s区,d区和ds区的元素都是金属 |
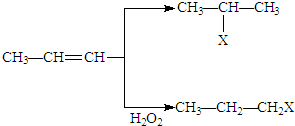 (X为卤素原子)
(X为卤素原子)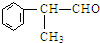 的物质,该物质是一种香料.
的物质,该物质是一种香料.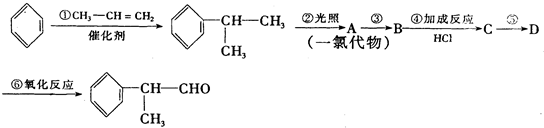
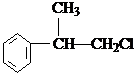 、
、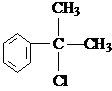 .
. .
. 、
、 、
、 任意2种.
任意2种. 糖类物质为很多生物生命活动提供能量.
糖类物质为很多生物生命活动提供能量.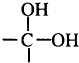 →
→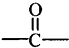 +H2O图中B和
+H2O图中B和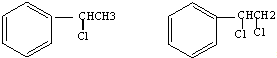 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳(过程中一些小分子未写出).
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳(过程中一些小分子未写出).
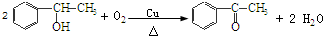 ’,该反应类型为氧化反应
’,该反应类型为氧化反应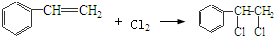 ,该反应类型为加成反应
,该反应类型为加成反应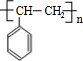
 、
、 、
、