题目内容
欲测定某铝铜合金的组成,进行了如下实验:
称取粉末状样品1.0 g,量取某浓度的盐酸20 mL,第一次往样品中加入盐酸10 mL,收集到标准状况下的气体224 mL;然后,再往样品中加入盐酸10 mL,又收集到标准状况下的气体112 mL。试求:
(1)所取盐酸的物质的量浓度;
(2)样品中铝的质量分数。
【答案】
(1)2.0 mol·L-1 (2)27%
【解析】由题意,当加入10 mL盐酸时,生成224 mL H2(0.01
mol),此时盐酸完全反应,因此盐酸的浓度为: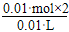 =2.0 mol·L-1;当再加10 mL盐酸时,只生成112 mL H2(0.005
mol),说明铝完全反应,根据反应2Al+6HCl===2AlCl3+3H2↑,生成0.015 mol H2,需用n(Al)=0.01 mol,
=2.0 mol·L-1;当再加10 mL盐酸时,只生成112 mL H2(0.005
mol),说明铝完全反应,根据反应2Al+6HCl===2AlCl3+3H2↑,生成0.015 mol H2,需用n(Al)=0.01 mol,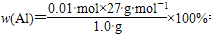 =27%。
=27%。

练习册系列答案
相关题目
为测定某铁铜合金的组成,现将5.6g该合金(表面氧化膜成分为Fe2O3和CuO)加入到过量稀硫酸中,完全反应后产生气体672mL,并得到浅绿色溶液A(不含Cu2+离子)和不溶物B.过滤,将B加入到适量的某浓度的硝酸中,完全溶解后,得NO、NO2的混合气896mL,经测定该混合气中V(NO):V(NO2)=3:1.再将A也加入到足量同浓度的硝酸中充分反应,用排水法收集产生的气体结果得一烧瓶气体,(不从水中移出烧瓶)紧接着向烧瓶中通入224mL O2,气体能恰好完全溶于水(以上所有气体体积都已换算成标准状况时的数据).下列结论正确的是( )
| A、合金中氧元素的物质的量是0.01 mol | B、合金中铁单质的质量是1.68 g | C、溶液A中存在的阳离子只有Fe2+离子 | D、不溶物B为铜单质且质量是1.6 g |