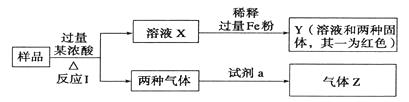
��Ŀ����
����Ŀ��ijѧϰС������DISϵͳ̽��ǿ��Ͳ�ͬ����кͷ�Ӧ��ʵ��������£�
�ٷֱ�����0.100 0 mol��L��1��NaOH��HCl��CH3COOH��Һ���á�
����0.100 0 mol��L��1��NaOH��Һ�ֱ�ζ�10.00 mL 0.100 0 mol��L��1��HCl��CH3COOH��Һ���������ݲɼ�����pH��������
���ɼ�������Ƶĵζ��������£�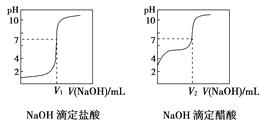
������ͼ��㲻ͬ��ԭ������
������ͼ��V1V2(�>������������<��)��
���𰸡�CH3COOH����ȫ���룬HCl��ȫ���룬ʹ0.1 mol��L��1��CH3COOH��Һ��c(H��)��ͬŨ�ȵ�HCl��Һ��c(H��)С��pH��>
��������������ǿ�ᣬ��ȫ���룬0.100 0 mol��L��1��HCl��ҺpH��1�������������ᣬ������ȫ���룬��0.100 0 mol��L��1��CH3COOH��ҺpH����1��V1��10.00 mL��V2<10.00 mL������V1>V2��
�����㾫����������Ҫ���������������ˮ��Һ�еĵ���ƽ�������к͵ζ������֪ʶ�㣬��Ҫ���յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ�����к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ������ȷ�����⣮