题目内容
常温下,将100 mL 的0.02 mol·L-1的Ba(OH)2溶液和100 mL 的0.02 mol·L-1的NaHSO4
溶液混合,若忽略溶液体积变化,则混合后的溶液
| A.pH=2 |
| B.pH=12 |
| C.由水电离产生的c(H+)=1.0×10-2 mol·L-1 |
| D.溶质的物质的量浓度为0.02 mol·L-1 |
B
解析试题分析:n(OH-)=0.004mol,n(H+)=0.002mol ,OH-过量,溶液显碱性,A错误;B、C(OH-)=0.002/0.2=0.01mol/L,pH=12,正确;C、由水电离产生的c(H+)=1.0×10-12 mol·L-1,错误;D、溶质只有Na2SO4,根据原子守恒,钠离子个数不变,体积变为原来的二倍,物质的量浓度为0.01
mol·L-1,错误。
考点:考查pH的计算

现有两瓶温度分别为15℃和45℃,pH均为l的硫酸溶液,下列有关说法不正确的是
| A.两溶液中的c(OH-)相等 | B.两溶液中的c(H+)相同 |
| C.等体积两种溶液中和碱的能力相同 | D.两溶液中的c(H2SO4)基本相同 |
在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的是
| A.Mg(OH)2的溶解度最小 | B.Ca(OH)2的溶解度最小 |
| C.AgCl的溶解度最小 | D.物质Ksp越大溶解度也越大 |
用食用白醋(醋酸浓度约1mol?L-1)进行下列实验,能证明醋酸为弱电解质的是
| A.白醋中滴入石蕊试液呈红色 |
| B.白醋能溶解氢氧化铜 |
| C.蛋壳浸泡在白醋中有气体放出 |
| D.pH试纸显示白醋的pH为2.3 |
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)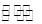 Ca2+(aq)+2OH-(aq) 当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
Ca2+(aq)+2OH-(aq) 当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
| A.溶液中Ca2+数目不变 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |
下列对混合后溶液的有关说法中,不正确的是( )
A.甲中:若a=7,则HA是强酸
B.乙中:若b≠0.2,则c(A-)≠c(Na+)
C.丙中:若HA是弱酸,则c(A-)>c(Na+)>c(H+)>c(OH-)
D.丁中:若c=9,则c(OH-)-c(HA)=10-9 mol·L-1
下列说法正确的是 ( )。
| A.反应A(g)??2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb)kJ·mol-1 |
| B.标准状况下,向0.1 mol·L-1的氨水中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) |
| C.足量的锌铜合金与100 mL pH=1稀硫酸反应,反应3 s时测得pH=2,假设反应前后溶液的体积保持不变,则3 s内产生氢气的平均速率是33.6 mL·s-1 |
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,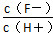 始终保持增大 始终保持增大 |
下列事实能说明醋酸是弱电解质的是( )
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸溶液中存在醋酸分子;
④常温下,0.1 mol/L醋酸的pH比0.1 mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2;
⑥0. 1 mol/L醋酸钠溶液pH=8.9;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢。
| A.②⑥⑦ | B.③④⑥⑦ | C.③④⑤⑥ | D.①② |
常温下,向0.1 mol/L的H2SO4溶液中逐滴加入0.1 mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是
( )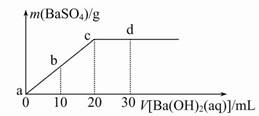
| A.a~d溶液的pH:a<b<c<d |
| B.a~d溶液的导电能力:a<b<c<d |
| C.b处溶液的c(H+)与d处溶液的c (OH-)相等 |
| D.c处溶液和d处溶液均呈碱性 |