题目内容
Cu、Cu2O和CuO组成的混合物,加入100mL0.6mol?L-1HNO3溶液恰好使混合物完全溶解,完全生成硝酸铜、一氧化氮和水.现共收集到224mLNO气体(标准状况).求:
1)相同物质的量的Cu、Cu2O和CuO,消耗该浓度硝酸最多的是哪一种物质,写出其与该硝酸反应的离子方程式.
2)如原混合物中含单质铜0.01moL,则其中Cu2O、CuO的物质的量分别为多少?
3)求混合物中CuO的物质的量可能接近的最大值.
解:1)反应的化学方程式分别为:
3Cu+8HNO3═3Cu(N03)2+2NO↑+4H2O,
3Cu2O+14HNO3═6Cu(N03)2+2NO↑+7H2O,
CuO+2HNO3═Cu(N03)2+H2O,
由方程式可以看出,1molCu消耗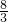 mol硝酸,1molCu2O消耗
mol硝酸,1molCu2O消耗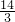 mol硝酸,1molCuO消耗2mol硝酸,
mol硝酸,1molCuO消耗2mol硝酸,
消耗该浓度硝酸最多的是Cu2O;
反应的离子方程式为3Cu2O+14H++2NO3-→6Cu2++2NO↑+7H2O,
答:耗该浓度硝酸最多的是Cu2O;该硝酸反应的离子方程式为3Cu2O+14H++2NO3-→6Cu2++2NO↑+7H2O;
2)利用N原子守恒:n(HNO3)=0.06mol,n(NO)=0.01mol,则n[Cu(NO3)2]= =0.025mol,
=0.025mol,
混合物中虽含有Cu、Cu2O和CuO三种物质,但参加氧化还原反应的只有 Cu、Cu2O,
所以利用电子守恒可直接求解.
转移电子的物质的量:n(e)=n(NO)×3=0.03mol,
Cu提供电子的物质的量:0.01×2=0.02mol,
Cu2O提供电子的物质的量:0.03-0.02=0.01mol
n(Cu2O)= =0.005mol
=0.005mol
铜原子守恒:n(CuO)=0.025mol-0.01mol-0.005mol×2=0.005mol
答:如原混合物中含单质铜0.01moL,则其中Cu2O、CuO的物质的量分别为n(Cu2O)=0.005mol;n(CuO)=0.005mol;
(3)等物质的量的铜与氧化亚铜失电子数相同,产生的NO相同,但消耗硝酸后者多.
进行极端假设:当铜最多,Cu2O趋于0时,CuO的物质的量为可能接近的最大值;
此时,根据电子守恒可知,n(Cu)= =0.015 mol
=0.015 mol
根据N原子守恒可知,n(CuO)= =0.01mol
=0.01mol
答:混合物中CuO的物质的量可能接近的最大值为0.01mol.
分析:1)根据反应的方程式判断消耗硝酸的量,并写出离子方程式;
2)利用N原子守恒、电子守恒和铜原子守恒进行计算;
3)利用端值法计算.
点评:本题考查混合物的计算,题目具有一定难度,本题利用守恒的方法和端值法计算.
3Cu+8HNO3═3Cu(N03)2+2NO↑+4H2O,
3Cu2O+14HNO3═6Cu(N03)2+2NO↑+7H2O,
CuO+2HNO3═Cu(N03)2+H2O,
由方程式可以看出,1molCu消耗
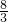 mol硝酸,1molCu2O消耗
mol硝酸,1molCu2O消耗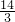 mol硝酸,1molCuO消耗2mol硝酸,
mol硝酸,1molCuO消耗2mol硝酸,消耗该浓度硝酸最多的是Cu2O;
反应的离子方程式为3Cu2O+14H++2NO3-→6Cu2++2NO↑+7H2O,
答:耗该浓度硝酸最多的是Cu2O;该硝酸反应的离子方程式为3Cu2O+14H++2NO3-→6Cu2++2NO↑+7H2O;
2)利用N原子守恒:n(HNO3)=0.06mol,n(NO)=0.01mol,则n[Cu(NO3)2]=
 =0.025mol,
=0.025mol,混合物中虽含有Cu、Cu2O和CuO三种物质,但参加氧化还原反应的只有 Cu、Cu2O,
所以利用电子守恒可直接求解.
转移电子的物质的量:n(e)=n(NO)×3=0.03mol,
Cu提供电子的物质的量:0.01×2=0.02mol,
Cu2O提供电子的物质的量:0.03-0.02=0.01mol
n(Cu2O)=
 =0.005mol
=0.005mol铜原子守恒:n(CuO)=0.025mol-0.01mol-0.005mol×2=0.005mol
答:如原混合物中含单质铜0.01moL,则其中Cu2O、CuO的物质的量分别为n(Cu2O)=0.005mol;n(CuO)=0.005mol;
(3)等物质的量的铜与氧化亚铜失电子数相同,产生的NO相同,但消耗硝酸后者多.
进行极端假设:当铜最多,Cu2O趋于0时,CuO的物质的量为可能接近的最大值;
此时,根据电子守恒可知,n(Cu)=
 =0.015 mol
=0.015 mol根据N原子守恒可知,n(CuO)=
 =0.01mol
=0.01mol答:混合物中CuO的物质的量可能接近的最大值为0.01mol.
分析:1)根据反应的方程式判断消耗硝酸的量,并写出离子方程式;
2)利用N原子守恒、电子守恒和铜原子守恒进行计算;
3)利用端值法计算.
点评:本题考查混合物的计算,题目具有一定难度,本题利用守恒的方法和端值法计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

