题目内容
硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2—3遍。
②向洗涤过的废铁屑加入过量的稀硫酸,控制温度50—80 ℃之间至铁屑耗尽。
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶。
④待结晶完毕后,滤出晶体,用少量冰水洗涤2—3次,再用滤纸将晶体吸干。
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请完成下列问题:
(1)实验步骤①的目的是____________,加热的作用是______________________________。
(2)实验步骤②明显不合理,理由是______________________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是__________________________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7 ℃、64 ℃温度下可同时析出两种晶体)。
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
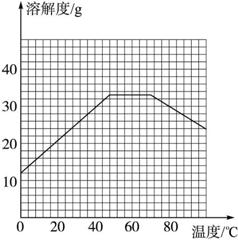
图3-8
(5)若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度(t)的范围为_______。
解析:本题是一道综合实验题,以物质的制备为载体,灵活考查了盐类水解、氧化还原、实验操作技能、信息采集和处理能力、数据分析和处理能力、绘图能力、实验方案评价能力,题目的设问采用了阶梯渐进式,由易到难,对同学们提出了较高的要求。因为采用了废旧的铁屑,其表面肯定带有油污,这对下面的溶解等很多过程都是不利的,故需要用热纯碱溶液先除油污;因为亚铁离子极易被氧化,所以在用硫酸溶解铁屑的时候,应该是铁屑过量;硫酸亚铁晶体在水中的溶解度随温度的升高而增大,所以在过滤时应该越低越好,本题采用了冰水洗涤杂质离子,就是这个意思;通过阅读图表可知,在溶液温度处于56.7 ℃和64 ℃之间时,硫酸亚铁的溶解度基本没有变化,所以在绘图时要注意这一信息;分析图表还可以看出,当温度处于56.7 ℃和64 ℃之间时,可以生成FeSO4·4H2O晶体。
答案:(1)除油污 升高温度,溶液碱性增强,去油污能力增强
(2)应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在
(3)洗涤除去晶体表面附着的硫酸等杂质,用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损耗
(4)
(5)56.7 ℃<t<64 ℃

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案 Fe3+的转化,A中Fe2+被__________,B中Fe3+作__________剂。
Fe3+的转化,A中Fe2+被__________,B中Fe3+作__________剂。 的相互转化,在A过程中,Fe2+做
剂,在B过程中,Fe3+做
剂。
的相互转化,在A过程中,Fe2+做
剂,在B过程中,Fe3+做
剂。