题目内容
(10分)按要求填空
(1)电子式:H2O ;Na2O2 ;结构式:CO2 ;N2 ;
(2)用第三周期元素的元素符号填空
原子半径最大的是(稀有气体除外) ;电负性最大的是 ;第一电离能最大的是 , 单质熔沸点最高的是 。
(3)以下是一些原子的2p能级或3d能级中电子排布的情况。试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。违反泡利不相容原理的有 ,违反洪特规则的有 。

【答案】
(1)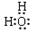 ;
;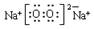 ;O=C=O;N≡N (2)Na; F; Ar; Si。
;O=C=O;N≡N (2)Na; F; Ar; Si。
(3)① ; ② ④
【解析】
试题分析:(1)水的电子式为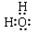 ,Na2O2的电子式为
,Na2O2的电子式为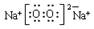 ,CO2的结构式为O=C=O,N2的结构式为:N≡N。
,CO2的结构式为O=C=O,N2的结构式为:N≡N。
(2)第三周期元素中,原子半径最大的元素是Na,电负性最大的元素是F,第一电离能最大的元素是Ar,单质溶沸点最高的元素是Si。
(3)泡利原理:每个原子轨道里最多只能容纳两个电子,且自旋相反。因此违反泡利原理的是①。洪特规则:原子核外电子在同一能级的不同轨道上排布时,总是优先单独占据一个轨道,而且自旋方向相同,因此违反洪特规则的是② ④。
考点:原子核外电子排布
点评:本题非常基础简单,主要掌握核外电子排布的基础知识即可。

练习册系列答案
相关题目



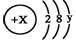 ,且X、Y 均为不大于20的正整数,据此回答下列问题:
,且X、Y 均为不大于20的正整数,据此回答下列问题: