题目内容
若不考虑空气等因素的影响,请完成下列问题:(1)将10 g铁粉加入到50 mL 2 mol·L-1的稀硫酸中,充分反应后生成硫酸亚铁的物质的量为______________。
(2)将a g生铁(成分是Fe和C)加入到b mL 2 mol·L-1的稀硫酸中,充分反应后生成氢气c L(标准状况),溶液中有黑色固体剩余。再加入少量稀硫酸,黑色固体不溶解,则生铁中Fe的质量分数是______________(用代数式表示)。
(3)将a g处理过的废铁屑(成分是Fe和Fe2O3)加入到b mL 2 mol·L-1的稀硫酸中,生成氢气c L(标准状况)。充分反应后生成硫酸亚铁的物质的量取值范围为:______________<n(FeSO4)≤______________ (用代数式表示)。
(1)0.1 mol (2)![]() (3)
(3)![]() mol
mol ![]() mol
mol
解析:(1)铁粉过量,以不足量稀硫酸计算n(FeSO4)=0.1 mol。
(2)Fe%=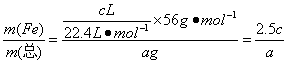
(3)若废铁屑中只有Fe,无Fe2O3,生成FeSO4量最少,n(FeSO4)=n(H2)=![]() mol,若废铁屑中Fe、Fe2O3对H2SO4过量或不足,情况复杂,但根据硫元素守恒易知n(FeSO4)≤n(
mol,若废铁屑中Fe、Fe2O3对H2SO4过量或不足,情况复杂,但根据硫元素守恒易知n(FeSO4)≤n(![]() )=b×10-3 L×2 mol·L-1,所以
)=b×10-3 L×2 mol·L-1,所以![]() mol<n(FeSO4)≤2b×10-3 mol。
mol<n(FeSO4)≤2b×10-3 mol。

练习册系列答案
相关题目