题目内容
某中学化学教材上有如下介绍:“在氢氧化钠浓溶液中加入氧化钙,加热,制得白色固体就是碱石灰,它是水和二氧化碳的吸收剂”.有两个实验小组决定通过实验来探究碱石灰的组成.
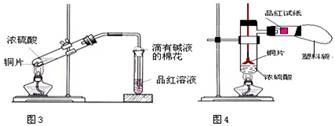
(1)第一小组设计的实验方案如下:
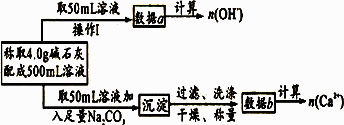
下列关于溶液中n(OH-)、n(Ca2+)、n(Na+)之间的关系式正确的是________
A.n(Na+)+2n(Ca2+)=n(OH-)
B.2n(Na+)+2n(Ca2+)=n(OH-)
C.n(Na+)+n(Ca2+)=2n(OH-)
现有4.0 g碱石灰,设其中n(Na+)=xmol,n(Ca2+)=ymol,请填写下列空格:
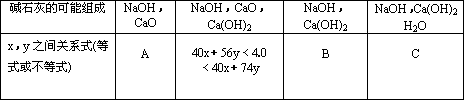
把表中A、C的关系式填在下面空格上:
A:________C:________.
(2)第二小组查得如下资料:氢氧化钙在250℃时不分解,高于250℃时才分解;氢氧化钠在580℃时不分解.他们设计了如下方案并得出相应相关数据:取市售碱石灰4.0 g,在250℃时加热至恒重,测得固体质量减少了0.6 g,剩余固体在580℃时继续加热至恒重,测得固体质量又减少了0.7 g.请通过计算确定该碱石灰各成分的质量分数?(要计算过程)
答案:
解析:
解析:
|
(1)(3分)A A:40x+56y=4.0 C:40x+74y﹤4.0 (2)(3分)NaOH%=13% Ca(OH)2%=72% H2O%=15% |

练习册系列答案
相关题目