题目内容
ΔH="-92" kJ·mol-1
N2(g)与H2(g)反应的热化学方程式为N2(g)+3H2(g) 2NH3(g),使1 mol的N
2NH3(g),使1 mol的N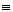 N键断裂吸收946 kJ的能量,使3 mol H—H键断裂共需吸收436 kJ·mol-1×3 mol="1308" kJ的能量,因此使1 mol N2(g)和3 mol H2(g)反应物的化学键断裂共需吸收的能量为946 kJ+1308 kJ="2254" kJ。而2 mol NH3(g)中含6 mol N—H键,形成6 mol N—H键时放出能量为391 kJ·mol-1×6 mol="2346" kJ。因此反应热应等于生成物分子形成时所释放的总能量(2346 kJ·mol-1)与反应物分子断裂时所吸收的总能量(2254 kJ·mol-1)的差,即放出了92 kJ·mol-1的能量,ΔH="-92" kJ·mol-1。
N键断裂吸收946 kJ的能量,使3 mol H—H键断裂共需吸收436 kJ·mol-1×3 mol="1308" kJ的能量,因此使1 mol N2(g)和3 mol H2(g)反应物的化学键断裂共需吸收的能量为946 kJ+1308 kJ="2254" kJ。而2 mol NH3(g)中含6 mol N—H键,形成6 mol N—H键时放出能量为391 kJ·mol-1×6 mol="2346" kJ。因此反应热应等于生成物分子形成时所释放的总能量(2346 kJ·mol-1)与反应物分子断裂时所吸收的总能量(2254 kJ·mol-1)的差,即放出了92 kJ·mol-1的能量,ΔH="-92" kJ·mol-1。
 2NH3(g),使1 mol的N
2NH3(g),使1 mol的N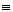 N键断裂吸收946 kJ的能量,使3 mol H—H键断裂共需吸收436 kJ·mol-1×3 mol="1308" kJ的能量,因此使1 mol N2(g)和3 mol H2(g)反应物的化学键断裂共需吸收的能量为946 kJ+1308 kJ="2254" kJ。而2 mol NH3(g)中含6 mol N—H键,形成6 mol N—H键时放出能量为391 kJ·mol-1×6 mol="2346" kJ。因此反应热应等于生成物分子形成时所释放的总能量(2346 kJ·mol-1)与反应物分子断裂时所吸收的总能量(2254 kJ·mol-1)的差,即放出了92 kJ·mol-1的能量,ΔH="-92" kJ·mol-1。
N键断裂吸收946 kJ的能量,使3 mol H—H键断裂共需吸收436 kJ·mol-1×3 mol="1308" kJ的能量,因此使1 mol N2(g)和3 mol H2(g)反应物的化学键断裂共需吸收的能量为946 kJ+1308 kJ="2254" kJ。而2 mol NH3(g)中含6 mol N—H键,形成6 mol N—H键时放出能量为391 kJ·mol-1×6 mol="2346" kJ。因此反应热应等于生成物分子形成时所释放的总能量(2346 kJ·mol-1)与反应物分子断裂时所吸收的总能量(2254 kJ·mol-1)的差,即放出了92 kJ·mol-1的能量,ΔH="-92" kJ·mol-1。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
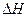 的绝对值均正确)
的绝对值均正确)